hydrolys
Hej, skulle behöva lite hjälp med denna frågan..
En hydrolys av acetylsalicylsyra kan ske när det bildas salicylsyra och ättiksyra. Reaktion är fullständig i basisk miljö, men inte i sura miljöer eller neutrala, varför kommer det sig?
Vet du hur hydrolysreaktionen sker?
mag1 skrev:Vet du hur hydrolysreaktionen sker?
När vatten adderas till ett ämne så sönderdelas det.
Hydrolysreaktionen kan ske vid samtliga "miljöer", d.v.s. från surt via neutralt till basiskt. Och i uppgiften står det att reaktionen endast sker fullständigt vid basiskt pH. Så hur tror du basen påverkar produkterna, som bildas efter hydrolysen?
Jag vet tyvärr inte.
Produkterna är salicylsyra och ättiksyra. Vad händer med dem om du har en syra närvarande, respektive en bas?
Kanske en syrabasreaktion när bas är involverad?
Hydrolys innebär att det är syrabas.
Skriv reaktionsformler för när acetylsalicylsyra reagerar med 1) hydroxidjon, 2) vatten, 3) oxoniumjon.
Och sedan?
Sedan kan vi kolla på dina formler och se om de är rätt. Om de stämmer kan vi gå vidare, annars är det ingen vits att fortsätta, eller hur?
Smaragdalena skrev:Sedan kan vi kolla på dina formler och se om de är rätt. Om de stämmer kan vi gå vidare, annars är det ingen vits att fortsätta, eller hur?
Har svårt med resultaten av alla.
Har du fått fram de tre reaktionsformlerna?
Verkar som jag sitter fast med resultaten
Okej jag förstår, så reaktionen sker fullständigt i basiska miljöer för där finns mer hydroxidjoner som kan reagera?
Nej inte riktigt. Denna reaktion sker med ester och natriumhydroxid löst i vatten, så det finns mycket mycket mer av vattenmolekylerna än hydroxidjoner, och både hydroxidjoner och vatten kan anfalla och få hydrolysen att ske.
Om pH är surt eller neutralt, är hydrolysreaktionen reversibel, det bildas m.a.o. en jämvikt mellan estern (acetylsalicylsyran) och produkterna (salicylsyran/ättiksyran). Och det är precis samma jämvikt som vid bildningen av estern (du betraktar bara att reaktionen går åt ena respektive andra hållet):
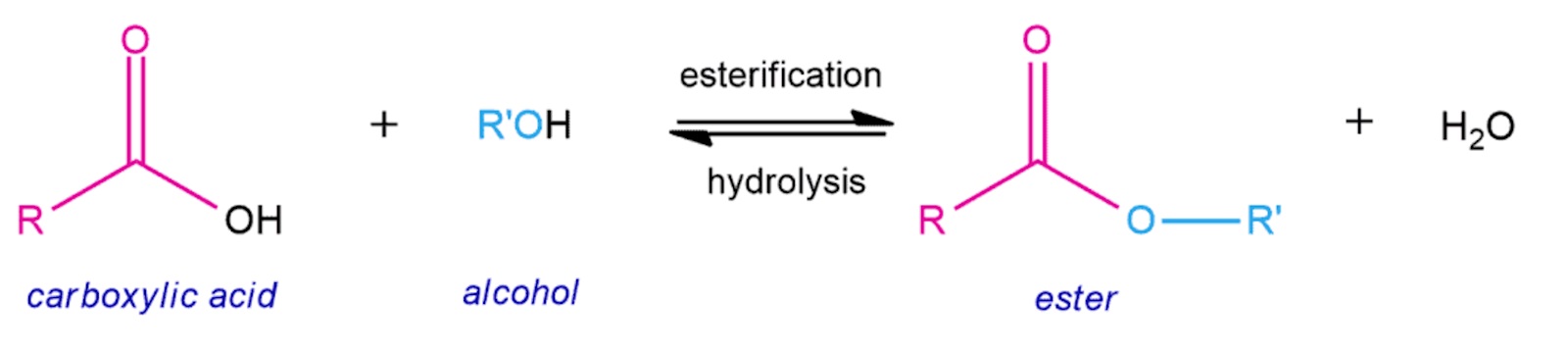
Vid reversibla reaktioner fås ofta en jämvikt, som vid esterifiering/hydrolys. Men om jämvikten störs, kommer produkterna av den ena reaktionen bildas, samtidigt som dessa produkter inte omvandlas tillbaka till reaktanterna. Motsvarande estern hydrolyseras till ättiksyran/salicylsyran.
Kan du komma på något sätt som gör att esterifieringsreaktionen försämras/avstannar, så att hydrolysreaktionen istället blir den enda som sker?
Nu gissar jag, men kan det ha med pH att göra?
itter skrev:Nu gissar jag, men kan det ha med pH att göra?
Ja det har absolut med pH att göra. Hydrolysreaktionen sker oavsett om pH är lågt-neutralt-högt.
Men esterifieringsreaktionen, katalyseras den av något?
syror, ämnen med protoner ?
Ja precis esterbildningsreaktionen katalyseras av protoner.
Dessa protoner kommer ofta ifrån en tillsatt syra, då sker reaktionen snabbast. Men vid neutralt pH finns det alltid en del oxoniumjoner närvarande (genom vattnets autoprotolys), och dessa joner kan dela med sig en proton och på så vis katalysera reaktionen.
Hydrolysreaktionen sker dessutom ännu mer effektivt med hydroxidjoner, som är ganska starka nukleofiler. Så hydrolysreaktionen sker effektivt, men esterifieringen sker (i princip) inte alls, inte så att det gå att upptäcka i alla fall, för (åter)bildad kommer effektivt och snabbt hydrolyseras igen.
(Utanför gymnasiekemin finns det en till faktor som minskar chansen för att esterifieringsreaktionen skall kunna ske.
Syrorna att protolyseras helt i och med att basen finns med. Och syrornas bildade negativa joner kommer att binda till sig den positiva jonen från basen, t.ex. natriumjonen i NaOH. Och denna bindning mellan plus och minusladdning kommer stabilisera syrans resonansform, d.v.s. stabilisera den negativa laddningen ytterligare. I och med att den är stabiliserad blir det svårare för karbonylkolets dubbelbindning att omlagras till ett av syrena, vilket är något som krävs under den protonkatalyserade esterifieringsreaktionen).
Jaha så det är därför hydrolysreaktioner inte är fullständiga i sura/neutrala miljöer. Finns det något mer än hydroxidjoner som katalyserar en hydrolys?
Hydroxidjonerna katalyserar inte reaktionen, de är en av reaktanterna, de förbrukas.
Okej, förstår!
Vid en sur hydrolys, kan en syra (därav "sur hydrolys") katalysera reaktionen, genom att låna ut en proton till karbonylkolet i karboxylsyran. Efter att ha bundit protonen blir karbonylkolet mer elektrofilt (d.v.s. mer attraktivt att anfalla för en nukelofil som en vattenmolekyl). Det sker på precis samma vis som när esterbindningen bildas, protonen underlättar nukleofilens attack.
mag1 skrev:Ja precis esterbildningsreaktionen katalyseras av protoner.
Dessa protoner kommer ofta ifrån en tillsatt syra, då sker reaktionen snabbast. Men vid neutralt pH finns det alltid en del oxoniumjoner närvarande (genom vattnets autoprotolys), och dessa joner kan dela med sig en proton och på så vis katalysera reaktionen.
Hydrolysreaktionen sker dessutom ännu mer effektivt med hydroxidjoner, som är ganska starka nukleofiler. Så hydrolysreaktionen sker effektivt, men esterifieringen sker (i princip) inte alls, inte så att det gå att upptäcka i alla fall, för (åter)bildad kommer effektivt och snabbt hydrolyseras igen.
(Utanför gymnasiekemin finns det en till faktor som minskar chansen för att esterifieringsreaktionen skall kunna ske.
Syrorna att protolyseras helt i och med att basen finns med. Och syrornas bildade negativa joner kommer att binda till sig den positiva jonen från basen, t.ex. natriumjonen i NaOH. Och denna bindning mellan plus och minusladdning kommer stabilisera syrans resonansform, d.v.s. stabilisera den negativa laddningen ytterligare. I och med att den är stabiliserad blir det svårare för karbonylkolets dubbelbindning att omlagras till ett av syrena, vilket är något som krävs under den protonkatalyserade esterifieringsreaktionen).
Det sista stycket du skrev, om resonans, har du någon källa på detta? Skulle behöva använda denna infon i en rapport jag skriver. Tack isåfall!
trulsmamma skrev:mag1 skrev:Ja precis esterbildningsreaktionen katalyseras av protoner.
Dessa protoner kommer ofta ifrån en tillsatt syra, då sker reaktionen snabbast. Men vid neutralt pH finns det alltid en del oxoniumjoner närvarande (genom vattnets autoprotolys), och dessa joner kan dela med sig en proton och på så vis katalysera reaktionen.
Hydrolysreaktionen sker dessutom ännu mer effektivt med hydroxidjoner, som är ganska starka nukleofiler. Så hydrolysreaktionen sker effektivt, men esterifieringen sker (i princip) inte alls, inte så att det gå att upptäcka i alla fall, för (åter)bildad kommer effektivt och snabbt hydrolyseras igen.
(Utanför gymnasiekemin finns det en till faktor som minskar chansen för att esterifieringsreaktionen skall kunna ske.
Syrorna att protolyseras helt i och med att basen finns med. Och syrornas bildade negativa joner kommer att binda till sig den positiva jonen från basen, t.ex. natriumjonen i NaOH. Och denna bindning mellan plus och minusladdning kommer stabilisera syrans resonansform, d.v.s. stabilisera den negativa laddningen ytterligare. I och med att den är stabiliserad blir det svårare för karbonylkolets dubbelbindning att omlagras till ett av syrena, vilket är något som krävs under den protonkatalyserade esterifieringsreaktionen).
Det sista stycket du skrev, om resonans, har du någon källa på detta? Skulle behöva använda denna infon i en rapport jag skriver. Tack isåfall!
Resonans är ett så vanligt begrepp inom organisk kemi att det borde inte behöva någon källa alls.
Resonans brukar vara beskrivet i kemiböckerna, t.ex. för aromatiska kolväten. Så det kan vara en källa.


