Hur vet man att protonerna är samlade i centrum?
Hej!
Läser just om Ernest Rutherfords experiment om hur atomen i stort sätt består av tomrum och hur atomerna har en positiv kärna som han bevisade genom att stråla α-partiklar på en guldfolie. I experimentet passerade de flesta partiklarna rakt igenom, medan ett fåtal studsade. Hans slutsats blev att atomen är består av ett tomrum och en liten kompakt kärna.
Det jag inte förstår är hur han kom fram till det. Hur drog han slutsatsen att eftersom de flesta partiklar åkte rakt igenom betyder det att atomen bestå av tomrum och en positiv/kompakt kärna.
Jag hoppas att ni förstår min fråga, annars kan jag försöka tydliggöra den mer.
Mvh
En alfapartikel är positivt laddad, och repelleras då alltså av positiva partiklar. Eftersom de flesta partiklarna bara passerar igenom består den största delen av tomrum, och där partiklarna studsar tillbaka måste det finnas positiva partiklar som repellerar alfapartiklarna.
Det enda sättet för de flesta partiklar att kunna passera ostört igenom guldfolien måste vara att det finns stora områden utan något som repellerar partiklarna. Titta på denna illustration, med några få, stora kluster av protoner:
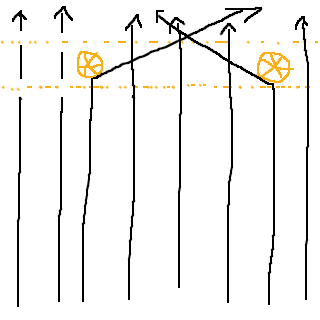
Och jämför med den här illustrationen, med utspridda protoner:
 (Dock blir krockarna inte riktigt lika raka)
(Dock blir krockarna inte riktigt lika raka)
AlvinB skrev:En alfapartikel är positivt laddad, och repelleras då alltså av positiva partiklar. Eftersom de flesta partiklarna bara passerar igenom består den största delen av tomrum, och där partiklarna studsar tillbaka måste det finnas positiva partiklar som repellerar alfapartiklarna.
Hej, tack för svaren. Det ända jag inte förstår är det det sistnämnda menar du att när partiklarna studsar tillbaka finns det en positiv kraft (positiva partiklar) som repellerar alfapartiklarna? Och vad menas med ”när partiklarna studsar tillbaka”. Tack!
Rutherford hade en hypotes (innan han gjorde experimentet) att många α-partiklar skulle fortsätta rakt fram och en del skulle böjas av lite. Bara för säkerhets skull sa han till sin doktorand att mäta åt ALLA vinklar, och till sin stora förvåning upptäckte de att vissa α-partiklar studsade tillbaka hundraåtttio grader. Rutherford kom fram till att det måste finnas nånting som α-partiklarna studsade mot - nånting som antingen var jättetungt eller positivt laddat. Innan hade man trott att atomen var som en positivt laddad deg med negativt laddade russin-elektroner i - den så kallade plumpudding-modellen.
Salsadansssar skrev:Hej!
Läser just om Ernest Rutherfords experiment om hur atomen i stort sätt består av tomrum och hur atomerna har en positiv kärna som han bevisade genom att stråla α-partiklar på en guldfolie. I experimentet passerade de flesta partiklarna rakt igenom, medan ett fåtal studsade. Hans slutsats blev att atomen är består av ett tomrum och en liten kompakt kärna.
Det jag inte förstår är hur han kom fram till det. Hur drog han slutsatsen att eftersom de flesta partiklar åkte rakt igenom betyder det att atomen bestå av tomrum och en positiv/kompakt kärna.
Jag hoppas att ni förstår min fråga, annars kan jag försöka tydliggöra den mer.
Mvh
Det kan vara värt att nämna att detta inte är sant med hänsyn till dagens kvantmekaniska beskrivning av atomen. Rutherfords teori om atomen är inom ramen för klassisk fysik. Se det lite mer som Historia.




.jpg?width=80&crop=0,0,80,80)
