Hur ska man göra med oxidationstal när samma atomslag dyker upp på fler än ett ställe?
Betrakta följande icke-balanserade redoxreaktion:
ClO3- -/-> ClO4- + Cl-
Nu dyker det ju upp en kloridjon bredvid jonen med klor i. När jag ska räkna på hur ox-talet för klor förändras, ska jag ränka på ett totalt genomsnitt då? Här då:
Cl: V -> III
Det enklaste är att sätta två kloratjoner i vänsterledet direkt och "låtsas" som att de är olika ämnen, där den ena oxideras och den andra reduceras.
Okej, tack. Men hur man ska räkna på hur ox-talet förändras?
2ClO3- -/-> ClO4- + Cl-
Hur förändras ox-tal här? Går det från V->III eller hur blir det?
Nej, hur kom du fram till +III?
Jag tog bara ett genomsnitt från högerledet. I ClO4- har klor +7 som ox-tal och i Cl- har den -1. Då tog jag ett genomsnitt på dem och det blev 3. Men uppenbarligen fungerar inte det. Hur ska man göra istället?
Det verkar som att du får välja metod, i så fall hade jag valt halvcellsmetoden. I så fall går det ut på att ta fram halvcellsreaktioner för:
Oxidation: ClO3- --> ClO4-
Reduktion: ClO3- --> Cl-
Jaha, okej. Jag tror att jag löste det. Jag vill dock bekräfta att jag gjorde rätt:
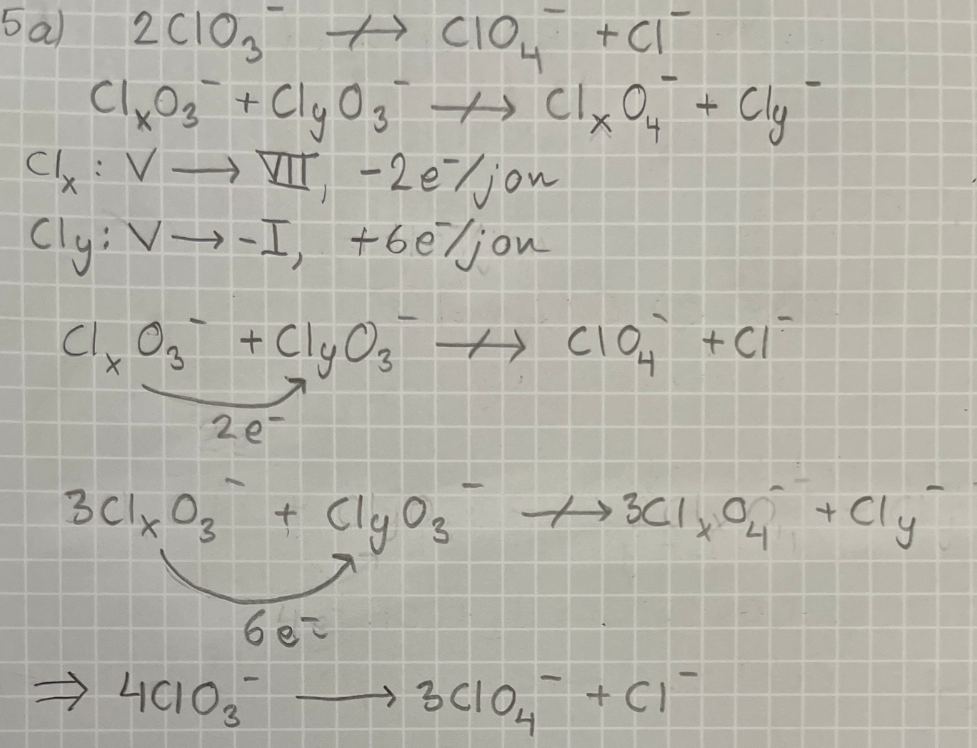
Det är rätt!



