Hur ska man gå tillväga?
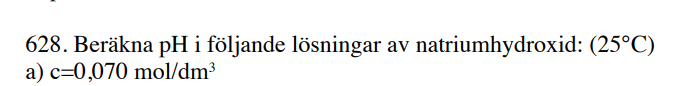
Det som jag tycker är konstigt är att man inte får veta hur mycket vatten det fanns från början. För natriumhydroxid kommer ju lösas upp enligt NaOH(s) → Na+(aq) + OH-(aq). Då tillsätts det ju en mängd hydroxidjoner. Men i vattnet från början fanns det ju också en mängd hydroxidjoner på grund av vattnets autoprotolys. Men eftersom man inte vet hur mycket vatten det fanns innan man tillsätte saltet vet man ju inte hur stor koncentrationen var innan. Alla hydroxidjonerna kommer ju inte från saltet, menar jag.
Sambandet [OH-][H3O+] = 10-14 M2 verkar också helt oanvändbart här, eftersom man saknar [H3O+] och [OH-].
Jag förstår hur du tänker, men mängden hydroxidjoner från autoprotolysen är försvinnande liten i relation till mängden hydroxidjoner från natriumhydroxiden. Du behöver inte veta någon volym. Utifrån uppgiftstexten kan du beräkna en koncentration av hydroxidjoner, vilket gör att du kan beräkna koncentrationen av vätejoner och sedan pH.
Aha, okej. Så mängden hydroxidjoner som fanns från början är försumbar jämfört med den tillsatta mängden?
Ja absolut. Koncentrationen hydroxidjoner i rent vatten är 10-7 mol/dm3, så du behöver ungefär 700 000 liter vatten för att tillföra lika stor mängd hydroxidjoner som du får från natriumhydroxiden i en liter lösning.



