Hur många pi-elektroner finns i färgämnet?
Halloj!
Jag håller på att skriva en labbrapport på en laboration där vi testade en enkel modell för att förutspå färgämnens maximala våglängd i absorptionsspektrum. Modellen bygger på antalet -elektroner i en given molekyl. En av molekylerna vi testade var 1,1'-dietyl-2,2'-cyanin (bild nedan).
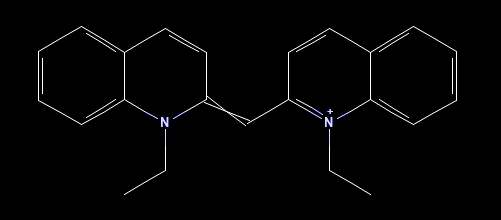
När jag räknar ihop -elektronerna får jag det till 20. Men i labbhandledningen står det att det är 22, och det är även det vi har räknat på. Jag misstänker att jag räknar fel då. Jag bara räknade 2 -elektroner/dubbelbindning. Och det finns 10 dubbelbindningar, så då får jag det till 20 elektroner.
Vad är det jag missar?
EDIT: tänker man att det fria elektronparet på en av kväveatomerna ligger i en icke-hybridiserad p-orbital och därför räknas som -elektroner?
Lite lurig fråga. Jag har inte räknat efter hur många av elektronerna som befinner sig i samma plan o.s.v. och faktiskt kan bidra till pi-bindningarna i ditt ämne. Kinolin (quinoline på engelska) själv har 10 pi-elektroner (de två fuserade ringarna), med samtliga atomer sp2 hybridiserade. Kolen bidrar med 9 elektroner och kvävet en.
Kvävet i ringen till vänster kan spontant se ut att vara sp3 hybridiserat, men båda atomerna som detta kväve binder till är sp2 hybridiserade och del av samma plan. Kvävet i ringen till höger är sp2 hybridiserat. Om vi jämför med kinolin där kvävet är sp2 hybridiserat, och antalet pi-elektroner är 10, så är det inte direkt överförbart till ditt ämne. Men kolet som binder ihop ringarna är sp2 hybridiserat, så bägge ringarna borde utgöra ett gemensamt pi-system, då delokalisation sker. I princip kan alla atomer (förutom de två kolen längst ner i bilden) arrangeras i samma plan - och då kan inte elektronerna hos kvävet till vänster ta vägen någon annan stans än i en orbital ovanför detta plan, precis som resten av pi-elektronerna. Utifrån geometrin och clashing tror jag det skulle vara mer optimalt (energimässigt) att pressa upp kvävets fria elektronpar till ovanför planet.
Tack för ditt utförliga svar!
Jag har dock några frågor.
men båda atomerna som detta kväve binder till är sp2 hybridiserade och del av samma plan.
Hur vet du att de ligger i samma plan? Är det för att ingen bindning "går ut" ur eller "in" i planet? Alltså att det saknas sådana här speciella bindningar i ritningen:

Kvävet i ringen till vänster kan spontant se ut att vara sp3 hybridiserat
Det var det jag trodde också. Jag bara tänkte att eftersom kvävet gör tre sigmabindningar och har ett fritt elektronpar så behöver den totalt sett 4 orbitaler, alltså borde det ha skett sp3 hybridisering. Är det alltså inte ett tankesätt som fungerar generellt?
naytte skrev:Tack för ditt utförliga svar!
Jag har dock några frågor.
men båda atomerna som detta kväve binder till är sp2 hybridiserade och del av samma plan.
Hur vet du att de ligger i samma plan? Är det för att ingen bindning "går ut" ur eller "in" i planet? Alltså att det saknas sådana här speciella bindningar i ritningen:
Ja det är ett sätt att se om ämnet är "plant". Ett annat är om ämnet är aromatiskt, för dylika ämnen är plana med sp2 hybridiserade kolatomer, och då sticker eventuella substituenter bara ut från ringen, d.v.s. atomerna ligger i samma plan som ett ark papper. sp2 hybridiseringen ger generellt bindningar i samma plan med 120° vinkel mellan bindningarna. Hur jag kom fram till att ämnet är aromatiskt kan jag inte riktigt sätta fingret på, det "såg aromatiskt ut" i mina ögon. En del av ämnet är i princip en bensenring, som är aromatisk. Och motsvarande för den andra delen av ringarna som liknar pyridin (även den aromatisk).
Kvävet i ringen till vänster kan spontant se ut att vara sp3 hybridiserat
Det var det jag trodde också. Jag bara tänkte att eftersom kvävet gör tre sigmabindningar och har ett fritt elektronpar så behöver den totalt sett 4 orbitaler, alltså borde det ha skett sp3 hybridisering. Är det alltså inte ett tankesätt som fungerar generellt?
Jo det fungerar nog generellt. Men alla atomer och bindningar påverkar strukturen/bidrar till ämnets egenskaper. Skulle det t.ex. vara fler väten i ringarna, som i ett mer mättat ämne så saknas de dubbelbindningar/hybridiserade orbitaler som ger pi-bindningar/aromaticiet - och i ett sådant ämne kommer inte kvävets elektroner hybridiseras på samma vis. Då skulle t.ex. hybridisering liknande sp3 kunna ske istället, eftersom de andra atomerna inte kan hybridiseras som sp2 tillsammans med kvävets (de andra atomerna är ju redan sp3 hybridiserade med fyra enkelbindningar). Så det fria elektronparet hamnar då i en egen orbital.
För all del! Bra att fråga på tills det blir klarare.
Ja okej, så man tänker här att eftersom alla kol i ringarna är sp2-hybridiserade så kan hela molekylen uppnå ett lägre energitillstånd om kvävet också sp2-hybridiseras istället för att sp3-hybridiseras, eftersom det då har en p-orbital över som kan delta i det delokaliserade systemet? Och aromaticitet brukar ju leda till stabilitet?
Ja lite så. Kolatomerna är sp2 och kväveatomens elektroner kan då enkelt hybridiseras så. Skulle inte sp2 hybridisering ske, skulle ytterligare/andra bindningar bildas - ämnet skulle vara "suget" på att reagera med något annat för att på så vis få en annan typ hybridisering och/eller ytterligare bindning. Att ämnet blir aromatiskt och jonen stabiliserad genom resonans mellan de två olika ringarna, är ju en förutsättning för att ämnet blir stabilt och inte reagerar vidare (med en likadan molekyl eller vad annat som finns i närheten).


