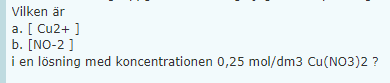
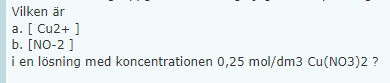
Hur löses denna? Koncentrationer, lösning
AlexanderJansson skrev:
Såhär tänker jag som en början:
(2(Cu)^2+)(aq) +(2(NO3)^2-)(aq) => Cu(NO3)2 (aq)
Är det något fel med reaktionen ovan?
Såhär tänker jag som en början:
(2(Cu)^2+)(aq) +(2(NO3)^2-)(aq) => Cu(NO3)2 (aq)
Är det något fel med reaktionen ovan?
Ja, det försvinner en kopparjon vid din reaktion.
Högerledet är korrekt.
Smaragdalena skrev:Såhär tänker jag som en början:
(2(Cu)^2+)(aq) +(2(NO3)^2-)(aq) => Cu(NO3)2 (aq)
Är det något fel med reaktionen ovan?
Ja, det försvinner en kopparjon vid din reaktion.
Högerledet är korrekt.
Jag är helt loss skulle du kunna visa hur man löser a samt varför man skriver upp formeln på ett visst sätt?
Ser du i uppgiften att formeln för saltet är Cu(NO3)2? Vad betyder den där nersänkta tvåan på slutet?
Smaragdalena skrev:Ser du i uppgiften att formeln för saltet är Cu(NO3)2? Vad betyder den där nersänkta tvåan på slutet?
Att den består av två stycken Cu(NO3)
Elelr menar dem 2 stycken (NO3)
Ja, varje formelenhet består av en kopparjon och två nitratjoner.
Hur många mol kopparjoner finns det i 0,25 mol Cu(NO3)2? Hur många mol nitratjoner finns det i 0,25 mol Cu(NO3)2?