Hur kan jag beräkna concentrationen fosforsyra och möjligtvis också kolsyra?
Såhär gick labbrationen ut. Jag hade 48ml kokad cola som då ska ha fosforsyra och vatten kvar. Jag sedan titrerade det med natriumhydroxid och jag behövde i slutet använda 12ml av natriumhydroxid (med koncentration 0.1 mol/dm^3) för att titrera det fullständigt och diagrammet är nedanför (ignorera den gröna funktionen). Jag har också lyckats beräkna att substansmängden av natriumhydroxid måste vara 0.12mol och fosforsyrans substansmängd måste då vara 0.04mol (se nedanför).
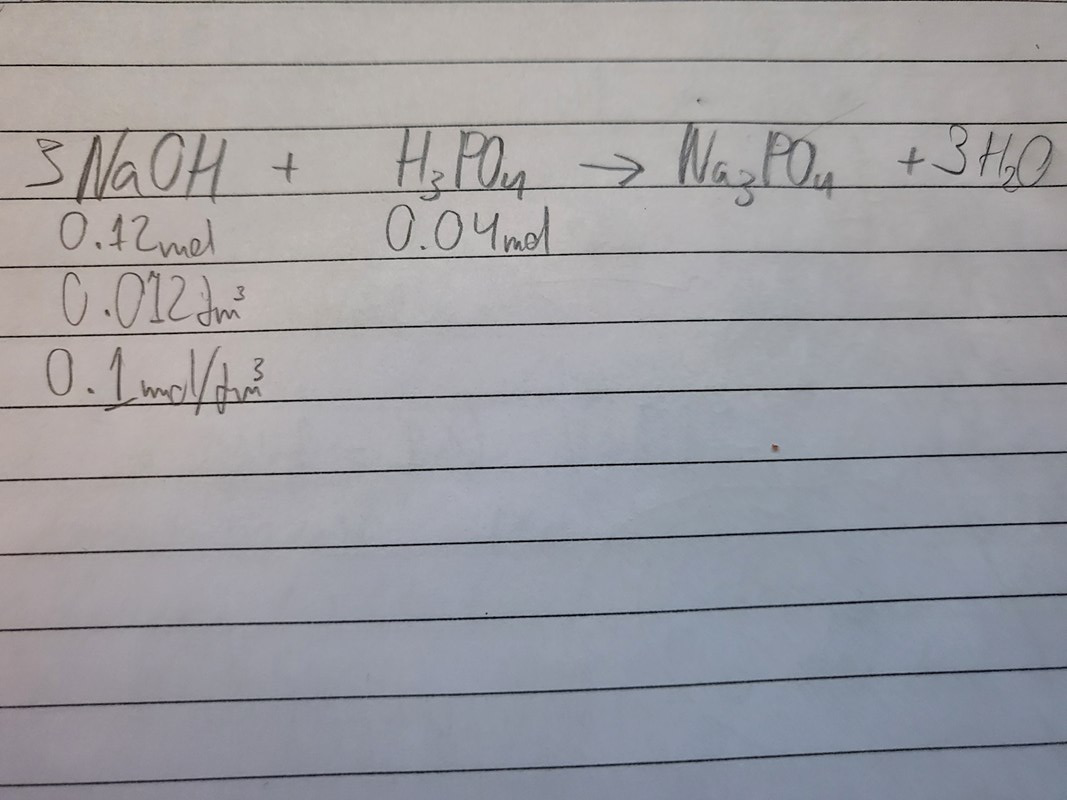
Så min fråga är då, hur kan jag beräkna volymen av fosforsyra och hur kan jag göra när det är två syror som är titrerade (fosforsyra och kolsyra med natriumhydroxid som det titreras med)?

Om du tillsatte 12 ml (0,012 dm3) av 0,1 mol/dm3 lösning så har du tillsatt 0,0012 mol NaOH, inte 0,12 mol. Nu ser det dock ut som att du har läst av titrerkurvan fel, för 12 ml är väl det du hade tillsatt när du avbröt titreringen? Man läser av titrerkurvan vid ekvivalenspunkten. I ditt fall finns två ekvivalenspunkter, en för första protonen och en för andra protonen. Eftersom fosforsyra är treprotonig hade du sett att det fanns en tredje ekvivalenspunkt om du fortsatte titreringen (det är dock svårt att titrera så man kommer till denna punkt).
Vid första ekvivalenspunkten har 1 mol natriumhydroxid reagerat med 1 mol fosforsyra och bildat 1 mol natriumdivätefosfat och 1 mol vatten. Skriv reaktionsformel för detta.
Vid andra ekvivalenspunkten har ytterligare 1 mol natriumhydroxid reagerat med 1 mol natriumdivätefosfat och bildat 1 mol dinatriumvätefosfat och 1 mol vatten. Skriv reaktionsformel för detta.
Man kan också sammanfatta dessa två steg som att 2 mol natriumhydroxid reagerar med 1 mol fosforsyra och bildar 1 mol dinatriumvätefosfat och 2 mol vatten fram till andra ekvivalenspunkten. Skriv formel även för detta.
Nästa fråga är vilken av de två ekvivalenspunkterna du ska använda för att beräkna hur mycket fosforsyra som fanns in provet. Vad har du för tankar kring det?
Först vill jag bara säga att jag har glömt av lite sedan jag gjorde dessa ekvationer senast fast ska det då se ut såhär?:
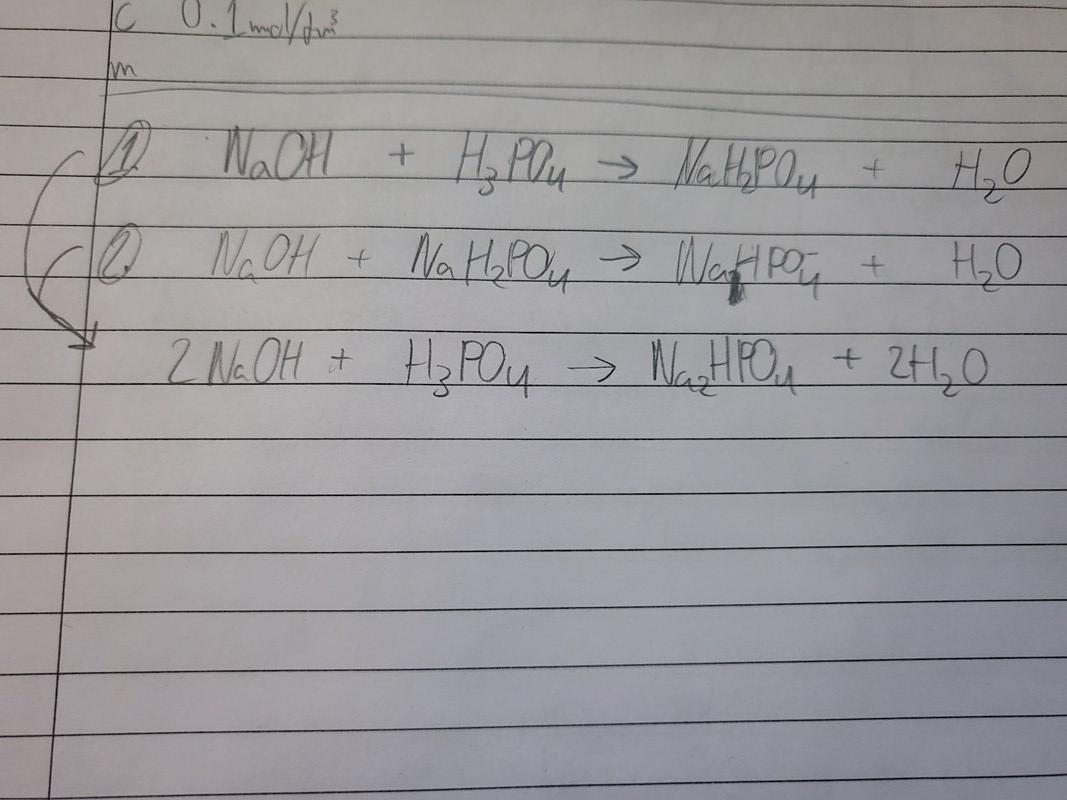
Jag skulle också gissa på att man borde använda den andra ekvivalenspunkten för att beräkna hur mycket fosforsyra fanns, är det korrekt?
Tillägg: 28 dec 2023 17:05
Eller kanske tredje ekvivalenspunkten om det hade varit möjligt?
Den tredje ekvivalenspunkten hamnar vid så högt pH att det inte går att titrera med NaOH för att komma dit.
Ja det är rätt! Du kan i princip lägga till ytterligare ett steg där du får trinatriumfosfat som produkt, det skulle motsvara den tredje ekvivalenspunkten som inte syns på din kurva.
Det är inte jättelätt att motivera varför man ska välja den ena eller den andra ekvivalenspunkten. En metod är att beräkna koncentrationen av fosforsyra från bägge punkterna och sedan beräkna ett medelvärde. Men jag hade nog också valt den andra punkten. Dels eftersom den syns tydligare på kurvan och är lättare att läsa av, dels eftersom du då har tillsatt mer av basen vilket gör att du får ett mindre procentuellt fel vid avläsningen.
Okej och om jag då vill beräkna volymen av dinatriumvätefosfat enligt den sammanfatta reaktionsformeln, hur ska jag klura ut vad C är då? Är det 10^-pH?
Tillägg: 28 dec 2023 17:26
alltså 10^-8.44 = 3.631*10^-9?
Nja, alltså du läser av volymen tillsatt NaOH-lösning vid ekvivalenspunkten. Vad motsvarar det?
Sedan räknar du ut hur stor substansmängd den volymen innehåller och konstaterar (utifrån reaktionsformeln) hur många mol fosforsyra som då måste ha reagerat. Det motsvarar substansmängden fosforsyra i provet du titrerade.
Detta är hur långt jag har kommit och nu är jag fast:
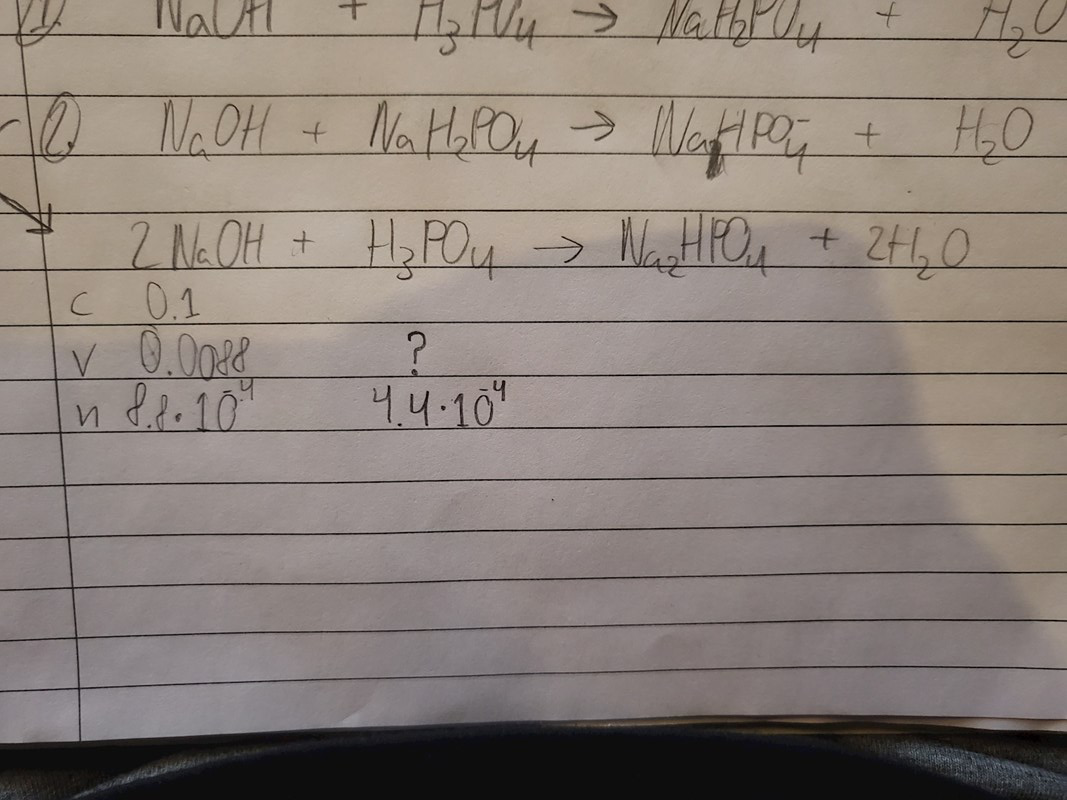
Du verkar ha läst av volymen korrekt (8,8 ml). Substansmängden NaOH är också rätt. Enligt formeln reagerar 2 mol NaOH med 1 mol H3PO4. Hur många mol H3PO4 reagerar då om det istället finns 8,8*10-4 mol NaOH?
Förlåt om jag missförstod (jag kan vara lite dum ibland) fast är det inte 4.4*10^-4 som jag skrev?
Ojdå, missade att du hade skrivit det redan!
Det stämmer. Vad blir då koncentrationen i provet du titrerade om det hade volymen 48 ml?
Menar du pH-nivån som man då använder för att beräkna concententration? Alltså 10^-8.44
Tillägg: 28 dec 2023 22:16
PS: Förlåt för att jag tog så lång tid. Jag var tyvärr litr upptagen med annat och jag glömde att titta här, förlåt.
pH är inte relevant i den här uppgiften, du behöver bara pH-värdena för att läsa av var ekvivalenspunkten ligger på kurvan.
Du titrerade 48 ml prov och har räknat ut att det fanns 4,4*10-4 mol fosforsyra i provet. Vilken koncentration motsvarar det? (Använd c=n/V)
Jaha så då är väl concentrationen 9.167*10^-3
Ja, men missa inte att skriva ut enheten och du borde avrunda svaret mer än du har gjort.
jaha okej, tack så mycket! :)



