hur drar man denna slutsats? (M)
Mg(NO3)2
om vi har exempelvis magnesiumnitrat som har koncentrationen 2,3 M, så kommer detta då innebära att detta upplöst i vatten blir till Mg2+ och NO-3 joner. för att beräkna koncentrationen av lösningen av de ingående jonerna kan man alltså dra slutsatsen att Mg koncentrationen är lika med den totala koncentrationen (i detta fall 2,3 M) medan NO3 koncentrationen är dubbelt så mycket.
hur drar man denna slutsats?
om den totala koncentrationen är 2,3 innebär det väl att man blandat ämnen tillsammans och hur är då magnesiums koncentration själv lika stor som den totala?
minns att det har något med förhållandet att göra, i detta fall blir det väl 1:1:2, men fattar inte riktigt hur?
Per magnesiumjon finns det två nitratjoner. Så om koncentrationen är 2.3 M (alltså 2.3 mol/dm3) av Mg(NO3)2 kommer det finnas dubbelt så många nitratjoner. På en hel enhet finns det två nitratjoner.
fattar resonemanget, men kan inte riktigt se det
just nu ser jag det såhär
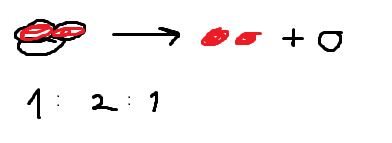
men det känns fortfarande lite konstigt att den totala substansmängden är lika med ett av ämnenas substansmängd, och att det ena ämnet dessutom har dubbelt så stor substansmängd som det totala?
hur kan de enskilda jonernas substansmängd vara lika med/dubbelt så mycket som det totala?
Om du har 1 mol Mg(NO3)2, hur många mol magnesium- respektive nitratjoner har du då?
naytte skrev:Om du har 1 mol Mg(NO3)2, hur många mol magnesium- respektive nitratjoner har du då?
1 mol magnesium
2 mol nitrat
Tillägg: 28 maj 2023 15:24
(som enligt mig totalt bör bli 3 mol) men jag vet att det inte funkar så, men förstår inte riktigt varför.. vet att de sitter ihop, men det känns ändå lite konstigt?
Om du har en korg med ett päron och två äpplen i, hur många päron respektive äpplen finns i en korg?
naytte skrev:Om du har en korg med ett päron och två äpplen i, hur många päron respektive äpplen finns i en korg?
en korg har då 1 päron och 2 äpplen
Precis. Om du har en jonförening med en magnesiumjon och två nitratjoner i, hur många magnesiumjoner respektive nitratjoner finns det då i en förening?
naytte skrev:Precis. Om du har en jonförening med en magnesiumjon och två nitratjoner i, hur många magnesiumjoner respektive nitratjoner finns det då i en förening?
gillar exemplet!
en jonförening behöver 2 nitratjoner och 1 magnesium jon för att bilda 1 magnesiumnitrat, vilket innebär att "antalet" av magnesiumnitrat och magnesium har samma substansmängd
Ja, exakt. Precis på samma sätt som antalet korgar är lika stort som antalet päron.
naytte skrev:Ja, exakt. Precis på samma sätt som antalet korgar är lika stort som antalet päron.
är det nitratjonen eller magnesiumjonen som begränsar reaktionen? (det kanske behövs mer information) men om man bara tänker mängdmässigt?
om vi exempelvis har 5 nitratjoner och 9 magnesiumjoner.
i detta fall hade det krävts 18 nitratjoner, alltså är det väl nitratjonerna som begränsar?
Som begränsar vilken reaktion?
naytte skrev:Som begränsar vilken reaktion?
bildningen av magnesiumnitrat
(jag bara tog något spontant, det kanske inte var så bra exempel)
Om det finns 5 nitratjoner och 9 magnesiumjoner finns det ett överskott av magnesiumjoner. Betrakta reaktionsformeln:
Mg+ + 2NO3- → Mg(NO3)2
På en magnesiumjon går det två nitratjoner. För att alla magnesiumjoner skulle reagera skulle det behövas 18 nitratjoner, men eftersom det endast finns 5 tar de slut först.
naytte skrev:Om det finns 5 nitratjoner och 9 magnesiumjoner finns det ett överskott av magnesiumjoner. Betrakta reaktionsformeln:
Mg+ + 2NO3- → Mg(NO3)2
På en magnesiumjon går det två nitratjoner. För att alla magnesiumjoner skulle reagera skulle det behövas 18 nitratjoner, men eftersom det endast finns 5 tar de slut först.
ja okej, det är alltså den som begränsar eftersom det finns ett underskott av ämnet?
Ja, det som tar slut först är det som begränsar.
naytte skrev:Ja, det som tar slut först är det som begränsar.
tack snälla för hjälpen


