Hur de räkna denna fråga?
hur de tänker på det?

Facit är 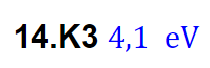
de användar 301,5 nm för våglängd men varför vi behöver att våglängd mindre än 240 nm eller hur?

Stephan70707 skrev:de användar 301,5 nm för våglängd men varför vi behöver att våglängd mindre än 240 nm eller hur?
Ozon absorberar vid 300 nm och kortare.
Du tog 240 nm men det ger jonisationsenergi för .
jag förstår inte kan du snälla förklara det för mig?
enligt facit de tog 301,5nm och inte 300nm
och när du har längre våglängd det betyder att det har lägre energi
Stephan70707 skrev:enligt facit de tog 301,5nm och inte 300nm
Det tror jag inte. Facit som du visade säger 4,1 eV. Det är vid en våglängd på 300 nm.
men varför de väljer 300 nm och inte 240nm eller inte 270 nm?
hur de tänker med detta?
om jag förstår rätt jönsationenergen är den energi som krav att tar ut ett elektron från en atom eller hur?
Stephan70707 skrev:men varför de väljer 300 nm och inte 240nm eller inte 270 nm?
hur de tänker med detta?
om jag förstår rätt jönsationenergen är den energi som krav att tar ut ett elektron från en atom eller hur?
Ja, och för ozon-molekylen är det 4,1 eV (våglängder kortare än 300 nm).
För syre-molekylen O2 var den kortaste våglängden given som 240 nm. Man måste läsa noga, men allt som behövs står där i uppgiftens text.
Men denna energi 4.1 ev kan inte garantera att ionizara ozon det kan bara excitera ozon utan ionization eller hur?
Stephan70707 skrev:Men denna energi 4.1 ev kan inte garantera att ionizara ozon det kan bara excitera ozon utan ionization eller hur?
Ja. Men det är "300 nm" är det rimliga svaret när man bara har textens information tillgänglig.
Molekyler (även med bara två eller tre atomer) är ganska mer komplicerade än atomer. När en så här molekyl absorberar UV-fotoner, händer det ofta att kovalenta bindningar blir brutna. Vid atomer finns det en rad Rydbergstillstånd strax under jonisationströskeln men för molekyler är det svårare.
Kan vi säger när vi vill räknar det ionization energi att ta den den längsta vågläng som atom eller molekylen kan absorberar och använda E=h.(c/lemda) alltid?
Stämner det?
Nej det stämmer inte alltid. Det beror på. På kontext, på hur mycket annan information det finns i uppgiften, på om det är gymnasium eller en universitetskurs i molekylfysik.
Stephan70707 skrev:Kan vi säger när vi vill räknar det ionization energi att ta den den längsta vågläng som atom eller molekylen kan absorberar och använda E=h.(c/lemda) alltid?
Stämner det?
Men om du kolla fråga har inte mycket info. De bara ge oss vilka våglängd som kan absorberas av ozon ???Jag är fysik 2 i komvux!!Är det stämmer som jag så här??
Jag gav ett svar på den här uppgiften. Det är ungefär sådant som Pluggakuten kan hjälpa med.
Sedan frågar du om något gäller alltid. Det är väl fler som gör här, men då svarar jag nästan aldrig ja. Det är nästan alltid möjligt för mig att tänka på andra situationer och uppgifter där det inte gäller.
tack för din hjälp. Men jag behöver att förstår varför de tar 300 nm. det finns ingen guarantee att den energi som 300 nm har kommer att ionization det kan bli bara att excitera ozon utan ionization ???
kan någon hjälpa mig snälla !!!!
I det här fallet skulle jag svara att det behövs minst 4,1 eV för att jonisera en ozonmolekyl (detta motsvarar 300 nm med två siffrors noggrannhet).
tack snälla!
Kan vi säger när vi vill räknar det ionization energi att ta den den längsta vågläng som atom eller molekylen kan absorberar och använda E=h.(c/lemda) alltid?
Stämner det?
Stephan70707 skrev:Kan vi säger när vi vill räknar det ionization energi att ta den den längsta vågläng som atom eller molekylen kan absorberar och använda E=h.(c/lemda) alltid?
Nej, det är inte alltid som det stämmer.
Ozon absorberar även infrarött ljus, till exempel vid 9,6 mikrometer.
Pieter Kuiper skrev:Stephan70707 skrev:Kan vi säger när vi vill räknar det ionization energi att ta den den längsta vågläng som atom eller molekylen kan absorberar och använda E=h.(c/lemda) alltid?
Nej, det är inte alltid som det stämmer.
varför vi kan tillämpa detta här och inte alltid. det är något jag inte förstår!!!!
Stephan70707 skrev:Pieter Kuiper skrev:Stephan70707 skrev:Kan vi säger när vi vill räknar det ionization energi att ta den den längsta vågläng som atom eller molekylen kan absorberar och använda E=h.(c/lemda) alltid?
Nej, det är inte alltid som det stämmer.
varför vi kan tillämpa detta här och inte alltid. det är något jag inte förstår!!!!
Finns någon som kan hjälpa mig snälla ? Thanks in advance




