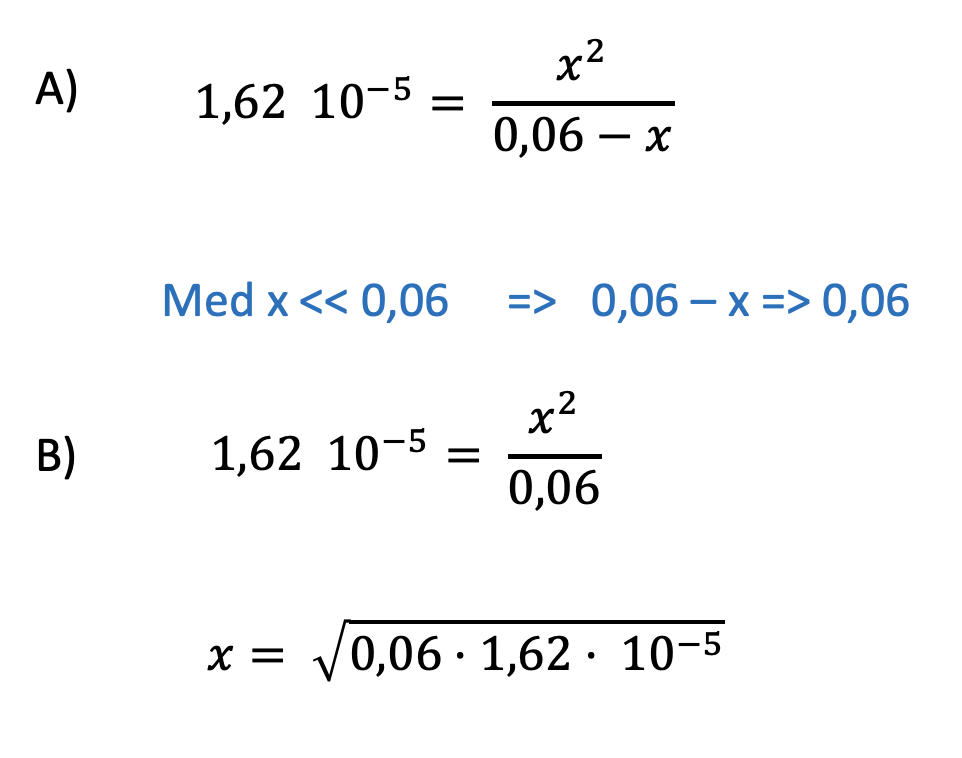Hemlaboration
Hej! Har fått i uppgift att göra en hemlaboration och hade behövt eran hjälp, då jag inte vet hur jag ska göra?
I försöket skall du först bereda en syralösning, beräkna dess koncentration och bedöma pH med hjälp av din rödkålsindikator. Sen skall du bereda en likadan lösning och späda den 10 gånger, beräkna dess koncentration och med hjälp av indikatorn bedöma om pH förändras.
Materiel:
•12-procentig ättiksprit (finns i handeln)
•2 glasburkar•ml mått (kryddmått, medicinmått eller motsvarande)
•din indikator
•Har du tillgång till avjoniserat vatten (batterivatten) är det bra men kranvatten duger också.
Utförande:
1.Häll en matsked (15 ml) ättiksprit i en ren väl ursköljd glasburk. Späd den till 50 ml med vatten/avjoniserat vatten. Tillsätt ca 10 droppar indikatorlösning. Bedöm pH. Spara innehållet i burken.
2.Gör en ny likadan lösning som i punkt 1. Späd den sedan till 500 ml. Tillsätt indikatorlösning, Bedöm pH.
3.Jämför innehållet i de båda burkarna. Vilka slutsatser drar du?
Redovisning:
Din labbrapport skall innehålla följande beräkningar:
•Vilken koncentration har 12% ättiksprit (ättiksyra)?Du kan räkna med att syrans densitet är 1,0 g/cm3
•Vilken koncentration har syra nr 1?
•Vilken koncentration har syra nr 2?
•Kan man eventuellt dra någon slutsats om hur pH förändras när en syra späds 10gånger?
Jag har kokat upp rödkål och har nu en pH indikator. Jag har följt anvisningarna och har två vätskor i bägare.
Jag vet inte hur jag ska räkna ut koncentrationen ättiksyra ifrån ättikspriten? Jag antar att jag ska använda mig av formeln c=n/V. Men vet inte hur jag ska få ihop det
Tacksam för svar
Du kan börjar med
1 Hur mycket ättiksyra är i 15 ml 12% ättika i g?
2 Vad är molvikt av ättiksyra i g/mol?
3 Därmed kan du beräkna hur mycket mol ättiksyra du har i 15 ml.
1) Jag tar 0,12*15=1.8g
2) CH3COOH molvikten = 60.0524 g/mol
3) 1.8/60,0524 = ~0,0299~0,03 mol
Typ så?
Tack för svar
Klarar du resten? Du måste ju fortfarande spädda ut dina 0,03 mol till 50 ml och 500 ml och därmed beräkna koncentrationer per liter ...
(Sedan kan du använda en formel att beräkna pH beroende från pKa och koncentration om du vill...)
Zockimon skrev:Klarar du resten? Du måste ju fortfarande spädda ut dina 0,03 mol till 50 ml och 500 ml och därmed beräkna koncentrationer per liter ...
(Sedan kan du använda en formel att beräkna pH beroende från pKa och koncentration om du vill...)
Om jag lägger in antal mol i formeln c=n/V så får jag:
n=0.03 mol och V= 50 ml som också kan skrivas 0.05 dm3
0.03/0.05=0,6. Alltså 60%
Samma sak med bägare nummer 2 som skulle späs ut till 500ml = 0,03/0,5=0,06. Alltså 6%
Är jag helt fel ute nu? =)
Nope,
Du har en koncentration av 0,03mol/50ml som du ska ange i mol/dm3
Och du har dessutom en koncentration av 0,03mol/500ml som du ska ange i mol/dm3
Vilken information fick du i dina pH mätningar?
Zockimon skrev:Nope,
Du har en koncentration av 0,03mol/50ml som du ska ange i mol/dm3
Och du har dessutom en koncentration av 0,03mol/500ml som du ska ange i mol/dm3
Vilken information fick du i dina pH mätningar?
Ok! Så jag ska inte använda procent som enhet, utan snarare 0.6 mol/dm3 samt 0.06 mol/dm3
Detta var resultatet jag fick ifrån instruktionerna, men ska jag bara mäta pH med hjälp av färgen på lösningarna?

•Vilken koncentration har 12% ättiksprit (ättiksyra)?Du kan räkna med att syrans densitet är 1,0 g/cm3
•Vilken koncentration har syra nr 1?
•Vilken koncentration har syra nr 2?
•Kan man eventuellt dra någon slutsats om hur pH förändras när en syra späds 10gånger?
De första tre borde du nu kunna svara på.
Själva experiment är lite klurig.
Har du kvar dina lösningar?
Man ser ju färgen rätt otydligt. Jag skulle har gissat att det ska finnas olika färger i båda lösningar. Men den till höger har för lite indikator
Kan du gör det så att du har 50 ml av varje lösning (0.6 mol/dm3 samt 0.06 mol/dm3) och tillsätter lika mängder indikatorlösning så att du verkligen kan se färgerna?
Om du känner koncentration och vet vilken syra det är så kan du kolla upp pKa och beräknar förväntad pH.
Du kan också googla pH värdet där din rödkål indikator byter färg.
Zockimon skrev:•Vilken koncentration har 12% ättiksprit (ättiksyra)?Du kan räkna med att syrans densitet är 1,0 g/cm3
•Vilken koncentration har syra nr 1?
•Vilken koncentration har syra nr 2?
•Kan man eventuellt dra någon slutsats om hur pH förändras när en syra späds 10gånger?
De första tre borde du nu kunna svara på.
Själva experiment är lite klurig.
Har du kvar dina lösningar?
Man ser ju färgen rätt otydligt. Jag skulle har gissat att det ska finnas olika färger i båda lösningar. Men den till höger har för lite indikator
Kan du gör det så att du har 50 ml av varje lösning (0.6 mol/dm3 samt 0.06 mol/dm3) och tillsätter lika mängder indikatorlösning så att du verkligen kan se färgerna?
Om du känner koncentration och vet vilken syra det är så kan du kolla upp pKa och beräknar förväntad pH.
Du kan också googla pH värdet där din rödkål indikator byter färg.

Färgen är starkare i glaset med högre koncentration ättika. Det andra glaset innehåller ju endast 1/10 av ättikan som glaset åt vänster. Jag tror att glaset åt vänster har pH värde 3 och det andra åt höger pH värde 4. Syran är starkare desto mindre pH och det skulle vara rimligt antar jag då pH värden är logaritmiska, alltså 10 gånger starkare motsvarar 1 mindre i ph-skalan. Tänker jag rätt? :)
Snyggt!
Man ser en tydligt skillnad. :) Om du vill göra det perfekt gör du en neutral jämförelseprov i form av 50 ml kranvatten med samma indikatormängd. Då borde färgen vara tydligt förändrat.
Jag kommer inte ihåg. Är rödkål röd vid syr pH och blå/lila i neutral basisk pH?
(Jag tycker att den ser lite mer lila ut till höger... därför är det bra att se hur det ser ut i neutralt vatten.)
Visst tog du lika mängder indikatorlösning i varje 50 ml ? :)
Hur kommer du på pH 3 och 4?
Vet du hur man räknar ut pH av en svag syra när man känner koncentration?
Zockimon skrev:Snyggt!
Man ser en tydligt skillnad. :) Om du vill göra det perfekt gör du en neutral jämförelseprov i form av 50 ml kranvatten med samma indikatormängd. Då borde färgen vara tydligt förändrat.
Jag kommer inte ihåg. Är rödkål röd vid syr pH och blå/lila i neutral basisk pH?
(Jag tycker att den ser lite mer lila ut till höger... därför är det bra att se hur det ser ut i neutralt vatten.)
Visst tog du lika mängder indikatorlösning i varje 50 ml ? :)
Hur kommer du på pH 3 och 4?
Vet du hur man räknar ut pH av en svag syra när man känner koncentration?
Jag tog 10 gånger mer rödkålsindikator i glaset åt vänster. Jag tittade på färgskalan för rödkålsindikator för att försöka få fram pH-värdet. Men jag ska räkna ut det istället, hur gör jag det?
Om du tog olika mängder indikator i lösningarna kan du inte jämföra resultatet.
Det ska vara lika stora mängder i båda (eller i alla 3 om du gör den 3. med kranvatten)
Du söker fram pKa av ättiksyra.
Sedan söker du en formel för att "beräkna pH av en svag syra"
Zockimon skrev:Om du tog olika mängder indikator i lösningarna kan du inte jämföra resultatet.
Det ska vara lika stora mängder i båda (eller i alla 3 om du gör den 3. med kranvatten)
Du söker fram pKa av ättiksyra.
Sedan söker du en formel för att "beräkna pH av en svag syra"
Ättiksyra har pKa=4.79. Är det Ka=10−pKa Som jag ska räkna ut? Alltså 10-4.79=1.6218*10-5?
Ättiksyra har pKa=4.79
Bra! Det var steg 1 !
Nu behöver du rätt formel för att räkna ut "pH av ättiksyra vid en viss koncentration"
Ingen gissning, du kan söka på nätet, det är inte svårt att hitta.
Zockimon skrev:Ättiksyra har pKa=4.79
Bra! Det var steg 1 !
Nu behöver du rätt formel för att räkna ut "pH av ättiksyra vid en viss koncentration"
Ingen gissning, du kan söka på nätet, det är inte svårt att hitta.
Jag har sökt, men förstår inte vilken det är, hittade en lång uträkning som innefattar pq-formeln, är det den jag ska använda?
Det blir en andragradsekvation,det stämmer,men man brukar kunna försumma x jämfört med ättiksyrans koncentration, så man behöver inte använda pq-formeln.
Smaragdalena skrev:Det blir en andragradsekvation,det stämmer,men man brukar kunna försumma x jämfört med ättiksyrans koncentration, så man behöver inte använda pq-formeln.
När jag söker på ättiksyras pKa får jag fram att det ska vara 4.79.
Ka=10−pKa=10−4,79=1.6218*10−5
Koncentrationen i det ena glaset är 0,06 mol/dm3 och 0,6 mol/dm3 i det andra.
Räknar jag då ut till att börja med syran med koncentrationen 0.06 mol/dm3 ställer jag upp:
Är det rätt såhär långt?
Jag tycker det ser bra ut!
Här finns en analog lösning under svag syra
https://www.naturvetenskap.org/kemi/gymnasiekemi/syror-och-baser/syra-basberakningar/
Om det blir för tufft kan du också använda som jag tror smaragdalena föreslog. Den kan man använda för svaga syror.
pH = 1/2 · (pKa - log10 c(HA))
Är det såhär jag ska göra? och sen räkna ut sista delen med pq formeln?
ja
Zockimon skrev:ja
Finns det något enklare sätt? Jag fick fram fel svar och känner att jag inte kommer hinna göra klart labbet över helgen om jag försöker igen. Kan testa pH = 1/2 · (pKa - log10 c(HA)) som du nämnde, tar jag pKa alltså syrakonstanten för ättika 4.79 - log10 c som i koncentrationen och vad är HA?
c är alltså t.ex 0.6 eller 0.06 i detta fallet va?
Taru skrev:Zockimon skrev:ja
Finns det något enklare sätt? Jag fick fram fel svar och känner att jag inte kommer hinna göra klart labbet över helgen om jag försöker igen. Kan testa pH = 1/2 · (pKa - log10 c(HA)) som du nämnde, tar jag pKa alltså syrakonstanten för ättika 4.79 - log10 c som i koncentrationen och vad är HA?
c är alltså t.ex 0.6 eller 0.06 i detta fallet va?
ja
Info för din labrapport:
Den enklare varianten som smaragdalena föreslog skulle har fortsatt i din räkning som följande baserande på att man antar att dissociation av denna svaga syra är försumbar liten (blåa delen)

om man skulle logaritmera det hela så är det ekvivalent med
pH = 1/2 · (pKa - log10 c(HA))
Resultatet borde vara samma. Du kan använda der i rapporten som en alternativ lösningsväg.
Om du vill kontrollera själv om du har kommit fram rätt, så finns det också sånna snygga online räknare...
https://www.inchcalculator.com/ph-calculator/
Zockimon skrev:Info för din labrapport:
Den enklare varianten som smaragdalena föreslog skulle har fortsatt i din räkning som följande baserande på att man antar att dissociation av denna svaga syra är försumbar liten (blåa delen)
om man skulle logaritmera det hela så är det ekvivalent med
pH = 1/2 · (pKa - log10 c(HA))
Resultatet borde vara samma. Du kan använda der i rapporten som en alternativ lösningsväg.
Om du vill kontrollera själv om du har kommit fram rätt, så finns det också sånna snygga online räknare...
https://www.inchcalculator.com/ph-calculator/
Räknar jag då ut
så får jag 9.859*10-4
gör jag samma sak med 0.6 så får jag 3.1*10-3
Ska jag testa värden såhär då?
-log(9.859*10-4) ~3pH
-log(3.1*10-3)~2.5pH
Återigen, tack för ditt tålamod! Hade inte klarat det utan dig :)