Grundnivå
Om en elektron deexciteras och sänder ut en foton med en viss våglängd och man får grundnivåns energi given, kommer den näst lägsta nivån ha mer energi än grundnivån?
Den näst lägsta nivån är väl alltid större än grundnivån (som är den lägsta)?
Så den näst lägsta nivån har större mängd energi?
Det är en högre energinivå ja. Det är därför det frigörs energi när en elektron hoppar från ett yttre skal till ett inre.
Är -4,5 eV mer eller -3,5 eV? (energi)
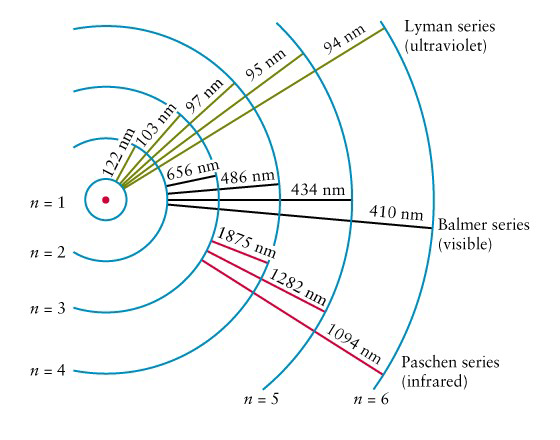 n=1 är grundtillståndet. Alla högre n är högre energinivåer.
n=1 är grundtillståndet. Alla högre n är högre energinivåer.
Vilken har mer energi -4,5 eV eller -3,5 eV? Jag skulle säga -4,5 eV. Vilket verkar vara fel?
-3,5 är på en högre energinivå. Du kan bara tänka det största talet (-3,5>-4,5) eftersom nivån för jonisering sätts till 0 eV. Så ju närmare 0 ju högre energi vilket oxå stämmer in på vanlig logik med jämförelse av tal.
eftersom nivån för jonisering sätts till 0 eV.
Kan du utveckla vad du menar här?
Tillägg: 21 maj 2024 22:43
Jag tänkte -4,5 skulle ha högre energi, tänkte lite som spänning men det är nog fel.
Här ett exempel där jag hade ritat på vänstra sidan två energiskalor:
 En skala lägger energi = noll vid grundtillståndet, den andra lägger E=0 vid oändligt långt bort.
En skala lägger energi = noll vid grundtillståndet, den andra lägger E=0 vid oändligt långt bort.
(Samma idé som med mgh i mekaniken, man kan välja nollnivån på golvet eller på bordet. Det gör ingen skillnad.)
Minst energi har den väl vid grundtillståndet? Sedan blir det högre energi ju fler energinivåer man kommer bort från grundtillståndet?
För väte är det exempelvis -13,6 eV i grundtillståndet (minst energi). Och ju mer man hoppar upp desto enerigirikare är det?
Tillägg: 21 maj 2024 22:56
eftersom nivån för jonisering sätts till 0 eV.
Vad menas med detta?
Man brukar sätta nivån till 0 när kraften mellan atomkärnan och elektronen är 0, d v s när atomen är joniserad. Om elektronen är nörmare än så är nivån negativ.
Det är precis som med temperaturer - minus 20 är kallare än minus fem.
plusminus skrev:Minst energi har den väl vid grundtillståndet? Sedan blir det högre energi ju fler energinivåer man kommer bort från grundtillståndet?
För väte är det exempelvis -13,6 eV i grundtillståndet (minst energi). Och ju mer man hoppar upp desto enerigirikare är det?
Ja, dessa stämmer.
Smaragdalena svarade på ditt tillägg.
Om en elektron i en väteatom exempelvis är exciterad till energinivå 5, hur räknar man ut den energi som krävs för att atomen ska bli joniserad? Ska man räkna energin då den hoppar från 5 till 0?
plusminus skrev:Om en elektron i en väteatom exempelvis är exciterad till energinivå 5, hur räknar man ut den energi som krävs för att atomen ska bli joniserad? Ska man räkna energin då den hoppar från 5 till 0?
Nej, om elektronen redan är i energinivå 5 skall man inte räkna med den energi som redan har tillförts till elektronen för att excitera den dit.
Hur räknar man ut den annars?
Vad är det man räknar på med formeln
-13,6/n2 ? är det energin i en viss energinivå?
plusminus skrev:Hur räknar man ut den annars?
Vad är det man räknar på med formeln
-13,6/n2 ? är det energin i en viss energinivå?
Ja, men jag vet inte i vilken enhet. Detta värde (fast positivt) är den energimängd du behöver tillföra till den exciterade elektronen för att atomen skall joniseras (d v s elektronen skall lossna från atomen).
Hur kommer det sig? Slits elektronen bort helt och hållet då?
Ja, som jag har skrivit flera gånger i den här tråden.
Men om det är ett annat ämne än väteatom då? Går det att räkna med Ek = hf - E0 eller krävs det andra formler?
plusminus skrev:Men om det är ett annat ämne än väteatom då? Går det att räkna med Ek = hf - E0 eller krävs det andra formler?
Det är svårt att veta vad du vill veta.
Jag gav i #10 en figur med en annan atom som har en jonisationsenergi på 23,1 eV.
Om en elektron i den atomen i #10 hade varit i energinivån över så hade det alltså krävts 16,6 eV för att jonisera atomen?
Det jag ville veta är om man kan beräkna denna energi som krävs för de olika energinivåerna för att jonisera en atom, som man kan göra med väte (-13,6/n2).
Värdena stämmer bra för väte men sämre för andra ämnen, eftersom de andra atomerna har fler elektroner som kretsar runt kärnan så att det blir krångligare att räkna på. Så det går, men bara om du accepterar ett dåligt värde.
Ah ok. Vilken formel/formler? Ingår det i fysik 2?
Nästan säker på att det är universitetsnivå. Läs här och byt gärna språk till engelska så står det mer.
plusminus skrev:Ingår det i fysik 2?
Ja. Det är bara energins bevarande.
Så informationen om nivåer ges (i en figur eller på annat sätt).
Rydbergs formel känner jag till och tas upp i fy2 men inte den under.
Om informationen om de olika nivåerna ges i en figuer eller genom text är det alltså bara att byta tecken på energin, så är det det som krävs för att slita loss elektronen?
Tillägg: 22 maj 2024 13:50
Rydbergs formel för vätet dock. Läste vidare nu och såg att den nämnaren var annorlunda om det är för andra ämnen, vilket är något vi inte pratat om.
plusminus skrev:är det alltså bara att byta tecken på energin
Jag förstår inte sådana frågor. Det handlar inte om matte och tecken.
Det är inte svårare än att välja nollnivå på golvet eller på bordet.
Eller att jorda en elektrisk krets vid minuspolen eller på ett annat ställe.
Det verkar vara väldigt svårt för många att inse att det inte spelar någon roll och att man kan välja vad som är mest bekvämt i situationen.
#10, där energin är -12,9, då krävs det alltså 12,9 eV för att jonisera elektroner?
Med byta tecken menar jag just det jag gjorde ovan, energin är -12,9 eV, för att jonisera en elektron ska man tillföra en lika stor mängd energi (med omvänt tecken, alltså +).
Det verkar vara väldigt svårt för många att inse att det inte spelar någon roll och att man kan välja vad som är mest bekvämt i situationen.
Tror att det beror på att det inte alltid går att välja vad som är mest bekvämt i situationen och räkna utifrån det. Oftast är det "såhär SKA man göra".
Har svårt att se att man kan välja sin nollnivå, är inte grundtillståndet alltid det man klassar som "nollnivå"?
plusminus skrev:#10, där energin är -12,9, då krävs det alltså 12,9 eV för att jonisera elektroner?
Man kan anta att atomen befinner sig i grundtillståndet. Den där atomens jonisationsenergi är 23,1 eV.
plusminus skrev:är inte grundtillståndet alltid det man klassar som "nollnivå"?
Nej. Man kan välja det oändliga som noll i energi, det är vanligt.
Tror att det beror på att det inte alltid går att välja vad som är mest bekvämt i situationen och räkna utifrån det. Oftast är det "såhär SKA man göra".
Jag kan inte komma på en enda situation i fysiken där man MÅSTE göra på ett visst sätt (däremot många situationer där de flesta skulle vara överens om vilket sätt som är enklast).
Har svårt att se att man kan välja sin nollnivå, är inte grundtillståndet alltid det man klassar som "nollnivå"?
Nej, nollnivån brukar sättas där atomen är joniserad, d v s där elektronen är så långt från kärnan att den elektrostatiska kraften mellan kärnan och elektronen är försumbar (jämfört med t ex hur stor rörelseenergi elektronen har). Det är därför elektronen har en negativ energi när den är bunden till kärnan. Hur många gånger har jag skrivit detta i den här tråden?




