Förutspå kokpunkter
Hej igen Pluggakuten! Trevlig söndag.
Jag har ett avsnitt som nyligen kommit upp i min kemikurs som jag inte riktigt känner att det har klarnat helt. Det handlar om att jämföra olika föreningar för att förutspå vilken som har högst kokpunkt. Min föreläsare hann inte gå igenom detta utan hänvisade till egen läsning.
Jag har själv antecknat dessa observationer kring kokpunkt:
- Om vi jämför två föreningar med samma "basämne": Fler elektroner ger högre kokpunkt (pga större atom, starkare Londonkrafter)
- Vätebindningar dominerar: de har hög kokpunkt.
- En tumregel från min bok: För väte-Halogenbindning: Lägre elektronegativitetsskillnad ger högre kokpunkt (pga starkare dipolmoment)
- Kompakthet: Kompaktare molekyler har högre kokpunkt. Exempelvis: linjär geometri är mindre kompakt än sfärisk.
Ni får gärna säga till om jag är ute och cyklar, eller om jag har missat något viktigt.
Nu försöker jag applicera detta på en uppgift:
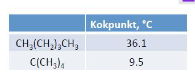
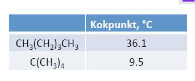
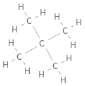
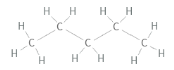
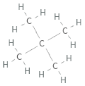
Förklara skillnaden i kokpunkt mellan nedanstående ämnen: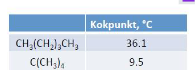
Båda har samma molekylära formel (vet inte om det är det formella namnet men tror ni förstår vad jag menar: expanderat blir det lika många C och H-atomer för respektive ämne)
v.s.
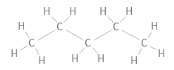
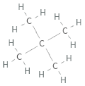
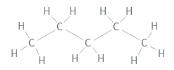
Jag ser ju från Lewis-strukturen att den med högst kokpunkt ser mer kompakt ut, men hur kan man formellt se det? I båda fall har ju centralatomerna (kol) lika många bindningar, så utifrån VSEPR blir strukturen kring kolatomerna tetrahedral i båda fallen, eller hur?
Det kokar ner till att jag nog inte riktigt förstår hur man systematiskt sett ska bryta ner sådana här typer av problem, de jag försökt på hittills har blivit gissningar (med blandade utfall, om man säger så)
(Uppgiften saknar för övrigt facit)
Som alltid, all hjälp uppskattas!
coffeshot skrev:Hej igen Pluggakuten! Trevlig söndag.
Jag har ett avsnitt som nyligen kommit upp i min kemikurs som jag inte riktigt känner att det har klarnat helt. Det handlar om att jämföra olika föreningar för att förutspå vilken som har högst kokpunkt. Min föreläsare hann inte gå igenom detta utan hänvisade till egen läsning.
Jag har själv antecknat dessa observationer kring kokpunkt:
- Om vi jämför två föreningar med samma "basämne": Fler elektroner ger högre kokpunkt (pga större atom, starkare Londonkrafter)
- Vätebindningar dominerar: de har hög kokpunkt.
- En tumregel från min bok: För väte-Halogenbindning: Lägre elektronegativitetsskillnad ger högre kokpunkt (pga starkare dipolmoment)
- Kompakthet: Kompaktare molekyler har högre kokpunkt. Exempelvis: linjär geometri är mindre kompakt än sfärisk.
Ni får gärna säga till om jag är ute och cyklar, eller om jag har missat något viktigt.
Nu försöker jag applicera detta på en uppgift:
Förklara skillnaden i kokpunkt mellan nedanstående ämnen:
Båda har samma molekylära formel (vet inte om det är det formella namnet men tror ni förstår vad jag menar: expanderat blir det lika många C och H-atomer för respektive ämne)
v.s.
Jag ser ju från Lewis-strukturen att den med högst kokpunkt ser mer kompakt ut,
Tvärtom, menar du väl? Kolvätet med lägst kokpunkt är nästan sfäriskt (en metylgrupp i varje hörn på en tetraeder) medan n-pentan är ganska avlång.
men hur kan man formellt se det? I båda fall har ju centralatomerna (kol) lika många bindningar, så utifrån VSEPR blir strukturen kring kolatomerna tetrahedral i båda fallen, eller hur?
Det kokar ner till att jag nog inte riktigt förstår hur man systematiskt sett ska bryta ner sådana här typer av problem, de jag försökt på hittills har blivit gissningar (med blandade utfall, om man säger så)
(Uppgiften saknar för övrigt facit)
Som alltid, all hjälp uppskattas!
Smaragdalena skrev:coffeshot skrev:Hej igen Pluggakuten! Trevlig söndag.
Jag har ett avsnitt som nyligen kommit upp i min kemikurs som jag inte riktigt känner att det har klarnat helt. Det handlar om att jämföra olika föreningar för att förutspå vilken som har högst kokpunkt. Min föreläsare hann inte gå igenom detta utan hänvisade till egen läsning.
Jag har själv antecknat dessa observationer kring kokpunkt:
- Om vi jämför två föreningar med samma "basämne": Fler elektroner ger högre kokpunkt (pga större atom, starkare Londonkrafter)
- Vätebindningar dominerar: de har hög kokpunkt.
- En tumregel från min bok: För väte-Halogenbindning: Lägre elektronegativitetsskillnad ger högre kokpunkt (pga starkare dipolmoment)
- Kompakthet: Kompaktare molekyler har högre kokpunkt. Exempelvis: linjär geometri är mindre kompakt än sfärisk.
Ni får gärna säga till om jag är ute och cyklar, eller om jag har missat något viktigt.
Nu försöker jag applicera detta på en uppgift:
Förklara skillnaden i kokpunkt mellan nedanstående ämnen:
Båda har samma molekylära formel (vet inte om det är det formella namnet men tror ni förstår vad jag menar: expanderat blir det lika många C och H-atomer för respektive ämne)
v.s.
Jag ser ju från Lewis-strukturen att den med högst kokpunkt ser mer kompakt ut,
Tvärtom, menar du väl? Kolvätet med lägst kokpunkt är nästan sfäriskt (en metylgrupp i varje hörn på en tetraeder) medan n-pentan är ganska avlång.
men hur kan man formellt se det? I båda fall har ju centralatomerna (kol) lika många bindningar, så utifrån VSEPR blir strukturen kring kolatomerna tetrahedral i båda fallen, eller hur?
Det kokar ner till att jag nog inte riktigt förstår hur man systematiskt sett ska bryta ner sådana här typer av problem, de jag försökt på hittills har blivit gissningar (med blandade utfall, om man säger så)
(Uppgiften saknar för övrigt facit)
Som alltid, all hjälp uppskattas!
Ah, jag måste ha blandat ihop kokpunkterna för de olika. My bad. Det säger mig lite mer, för det ser ju vid första anblick ut som att n-pentan har större ytarea och som jag förstått det: om de har samma typ av "dominant" intermolekylär kraft så spelar ytarea roll.
Då har jag virrat bort mig när jag skriver det här i OP också, eller hur?
- Kompakthet: Kompaktare molekyler har högre kokpunkt. Exempelvis: linjär geometri är mindre kompakt än sfärisk.
Det ska vara tvärtom, right?
Det jag också läst online är att "branching" ska påverka. Detsamma sägs här. Det är vad vi ser här, inte sant?
Kompaktare molekyler borde väl betyda mer sfäriska, så då har du inte blandat ihop det, utan skrivit rätt.
Smaragdalena skrev:Kompaktare molekyler borde väl betyda mer sfäriska, så då har du inte blandat ihop det, utan skrivit rätt.
Okej, då hänger med med! Ursäkta förvirringen. Har låtit denna vila i ett par dagar så jag har haft tid att fundera lite.
Essensen verkar vara molekylens storlek, kompakthet, bindningstyp och hur de är sammanfogade. Jag gör några fler uppgifter på området, och om det inte uppkommer några övriga frågor så markerar jag tråden löst. Tack för hjälpen!