Förstår inte facit

Jag lyckades lösa den här uppgiften och få rätt svar. Men när jag kollar i facit står det att reaktionsformeln för fosforsyrans protolys är H3PO4 + 2OH- → 2H2O + HPO42-.
Borde den inte vara H3PO4 + 2H2O → 2H3O+ + HPO42-?

Jag bifogar min lösning nedan. Är det bara ett sammanträffande att jag fick rätt svar?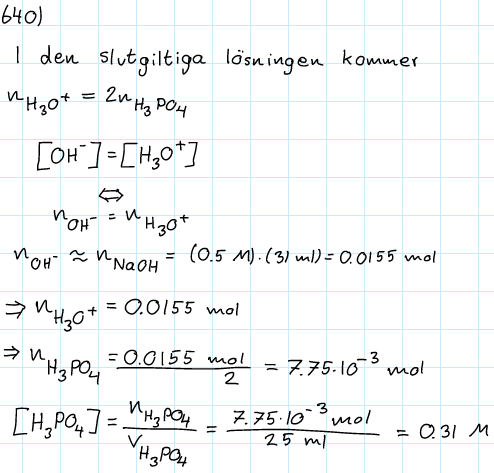
När man titrerar fosforsyra så avger syran vätejoner till hydroxidjoner, inte till vatten som är fallet när fosforsyra genomgår protolys i vatten. Hydroxidjonen är en mycket starkare bas än vattenmolekylen.
Om jag tolkar din lösning rätt så tänker du att fosforsyra först avger vätejoner till vatten så att det bildas oxoniumjoner, varefter dessa i sin tur avger vätejoner till hydroxidjonerna så att det bildas vatten. Totalt sett blir resultatet då att fosforsyran avger vätejoner till hydroxidjonerna, så svaret blir samma som med metoden i facit. Är din metod fel? Nja, skulle jag väl säga. Facits metod är mer logisk och enkel att följa eftersom den antar att fosforsyran avger vätejoner till hydroxidjoner direkt vilket är närmre sanningen. Men det är ingen tillfällighet att din metod fungerade, utan man kan räkna så också för att komma fram till svaret.
Ofta när det gäller reaktioner och jämvikter i vattenlösning kan man ha olika angreppssätt och komma fram till samma svar.
Jag tänkte inte på någon vattenbildning i min lösning. Det jag tänkte var att fosforsyran protolyseras i två steg, så att n(H3O+)=2n(H3PO4). Sedan tänkte jag att lösningen skulle vara neutral redan där, dvs att [H3O+]=[OH-]. Det medför då att n(H3O+) = n(OH-). På något sätt gav det samma svar?
Jag förstod inte att fosforsyran skulle reagera med hydroxidjonerna, utan trodde att det bara skulle vara att tillsätta H3O+ tills lösningen blev neutral och gav ett färgöverslag.
Du verkar tänka att fosforsyra är en stark syra, men det är en halvstark syra vid första protolyssteget och en svag syra i andra protolyssteget. Dominerande species i en vattenlösning av fosforsyra är fortfarande fosforsyramolekylen (oprotolyserad). Att en vattenlösning av fosforsyra skulle vara neutral efter att ha protolyserats i två steg förstår jag däremot inte...
Titrering innebär väl att man tillsättar en viss mängd av en lösning med känd koncentration till en viss mängd av en lösning med okänd koncentration, tills dess att den okända lösningen blir neutral?
Det enda vi har labbat med i labbet är BTB så jag antog att fenolftalein fungerade likadant. Alltså att den slår över precis när det finns ungefär lika mycket av hydroxidjonerna och oxoniumjonerna.
Du blandar ihop neutralisation med titrering. Vid titrering måste pH inte nödvändigtvis vara neutralt när man har nått ekvivalenspunkten. Fenolftalein använder man vid titrering av svaga syror eftersom deras ekvivalenspunkt befinner sig på svagt basiskt område, dvs där fenolftalein har sitt omslagsintervall (8,2-10). Titrerar man istället en stark syra blir det som du säger där man i princip bara har oxoniumjoner i lösningen som kan reagera med hydroxidjonerna. Då ligger ekvivalenspunkten vid neutralt pH och då behöver man en indikator som slår om runt pH 7, t.ex. bromtymolbått (BTB) som har omslagsintervallet 6,0-7,6.
https://www.formelsamlingen.se/alla-amnen/tabeller/kemi/syra-bas-indikationer
Titrerar man istället en svag bas genom att tillsätta en stark syra kommer ekvivalenspunkten finnas strax under pH 7, då skulle någon av de andra indikatorerna vara lämpliga.
Ja men oj, där missade jag allt en stor detalj! En fråga: när du anger omslagsintervallet, är det pH-värdet du syftar på då?
EDIT: glöm frågan. Såg nu att det var pKa.
Omslagsintervallet är det pH-intervall där indikatorn skiftar färg. Man vill att det ska ligga ungefär vid det pH där ekvivalenspunkten finns.
Jag förstår. Det konstiga är att jag gjorde samma feltänkande på en liknande uppgift men då fick jag också rätt svar. Så det verkar som att jag tänker fel men det blir rätt av slumpen. Tack så mycket för hjälpen!



