Förklara termodynamiskt varför salpetersyra och salpetersyrlighet är olika starka syror

Nedan har jag ritat upp de olika molekylerna:
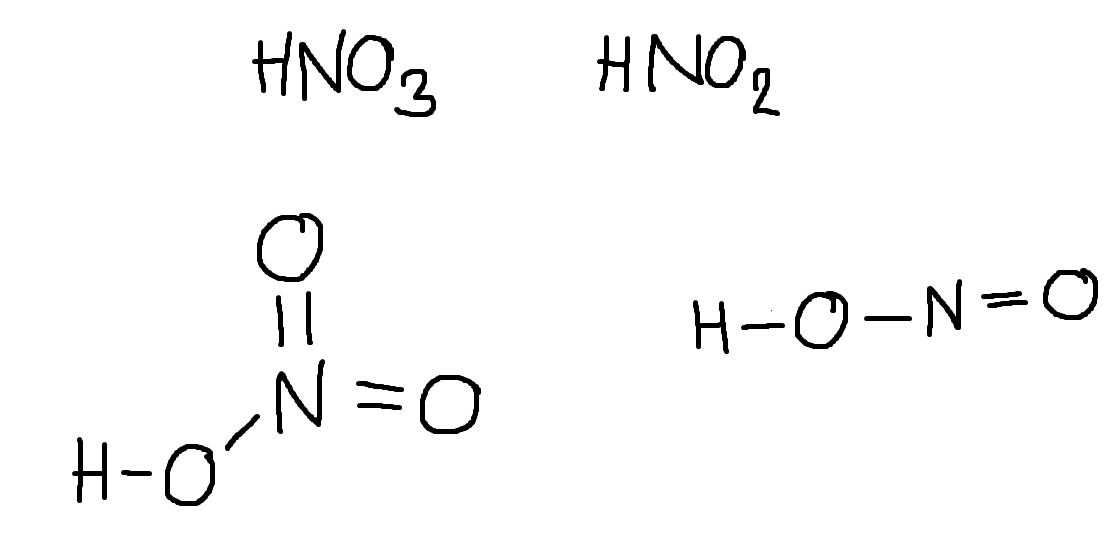
Rent termodynamiskt skulle jag säga att salpetersyra är starkare än salpetersyrlighet på grund av att nitratjonen har tre resonansformer medan nitritjonen endast har två. På grund av detta kommer salpetersyrans protolys vara exoterm medan salpetersyrlighetens protolys är endoterm. Detta gör att den totala entropin ökar mycket mer vid protolysen av HNO3 än av HNO2. När man löser salpetersyra kommer omgivningsentropin alltid att öka, medan den alltid kommer minska i salpetersyrlighetens fall. I båda fallen kommer förändringen av systementropi se ungefär likadan ut vid lösning.
Tycker ni att denna förklaring räcker? Missar jag något?
Förklaringen är som du är inne på att fler syren innebär fler resonansstrukturer. Om en vätejon avges bildas en anjon. Om denna kan sprida ut sin extra minusladdning över större delar av strukturen blir den mer stabil, vilket resonansen hjälper till med. Utan denna möjlighet kommer laddningen vara fokuserad på en syreatom vilket gör att den lättare binder till den positiva vätejonen igen och förhindrar protolys. Det skulle jag säga är den förklaring utifrån struktur man är ute efter. Det finns faktiskt ett namn för detta - Paulings regel. Den säger att styrkan hos en oxosyra, alltså en syra som kan skrivas på formen M(OH)a(O)b ungefär följer sambandet pKa = 8-5b.
Den termodynamiska förklaringen man är ute efter tror jag har att göra med styrkan i OH-bindningen. Med fler syren minskar elektrondensiteten runt OH-bindningen vilket gör den svagare, med andra ord kostar det mindre energi att bryta en sådan bindning. Det får till följd att protolysen blir mer exoterm vilket gör reaktionen mer spontan, alltså blir pKa lägre med ökande antal syren. Denna princip brukar kallas induktiv effekt:
Jaha, så det har med induktiv effekt att göra? Det vill säga att de mer elektrondragande syreatomerna förskjuter elektronfördelningen i molekylen närmare sig?
Tillägg: 20 apr 2023 13:56
Alltså rent termodynamiskt då.
Men kan man inte resonera utifrån entropi som jag försökte? Eller är det inte applicerbart här?
Att resonera utifrån entropi är svårt, i bägge fallen har du en neutral molekyl som dissocierar i en vätejon och en anjon. Vilka effekter detta får för entropiändringarna i system och omgivning är inte lätt att hålla reda på, speciellt inte vad skillnaderna blir mellan salpetersyra och salpetersyrlighet.
Generellt är det ganska ovanligt att man använder entropibegreppet inom kemin, oftast pratar man om entalpi och Gibbs energi istället.
Okej, jag förstår. Så induktion och resonans är alltså förklaringarna, fattar. Tack så mycket!



