Fördelning av 1-klorpropan och 1-propanol i jämviktsblandning
Hej!
Jag har några frågor angående ett diagram och en förklaring i min lärobok.
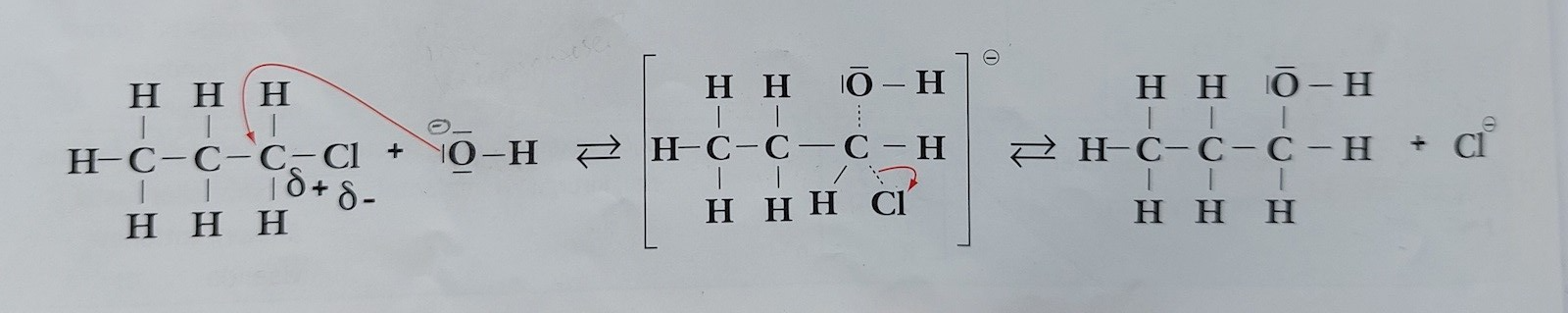
1-klorpropan reagerar med hydroxidjoner
Det står: "Differensen mellan utgångsämnenas och produkternas entalpier avgör fördelningen av ämnena i jämviktsblandningen."
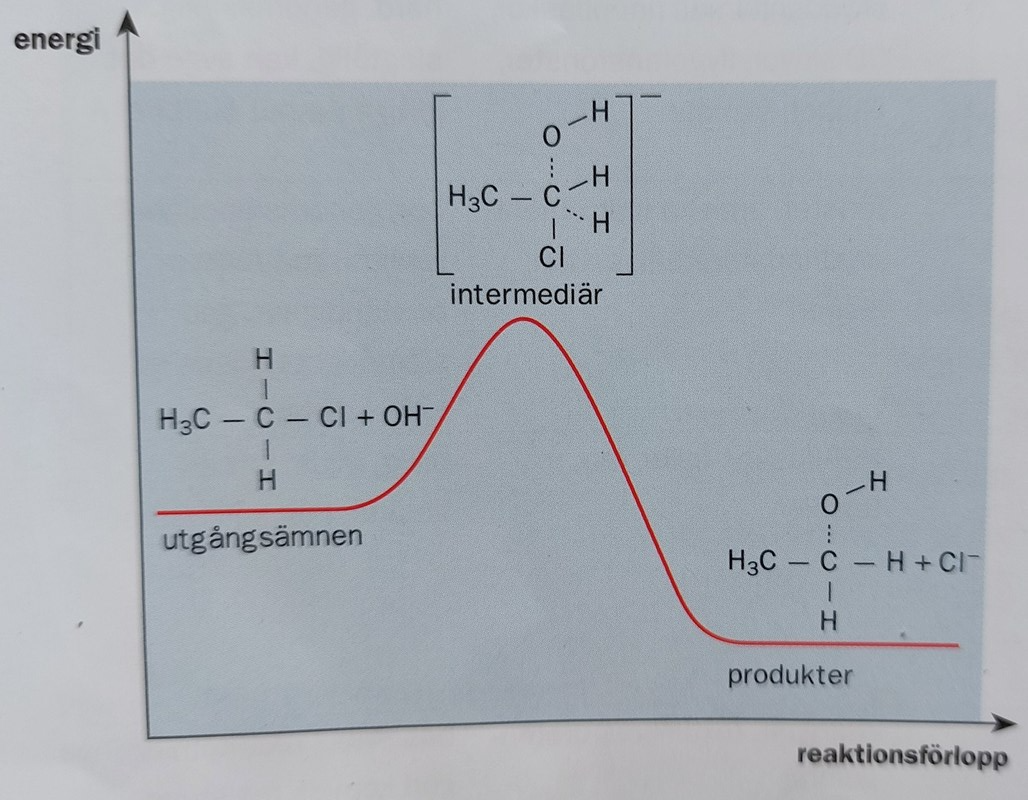
Utifrån diagrammet ser jag att entalpin för utgångsämnena är högre än för produkterna, men jag är osäker på hur jag ska tolka det. Vilket av ämnena finns det mest av i jämviktsblandningen?
Tänker jag rätt om jag tänker att om entalpin för utgångsämnena hade varit samma som för produkterna hade förhållandet mellan dem varit 1:1?
Jag ser att reaktionen är exoterm åt höger och endoterm åt vänster. Är det något jag kan använda mig av?
Tack på förhand!
linsun06 skrev:Hej!
Jag har några frågor angående ett diagram och en förklaring i min lärobok.
1-klorpropan reagerar med hydroxidjoner
Det står: "Differensen mellan utgångsämnenas och produkternas entalpier avgör fördelningen av ämnena i jämviktsblandningen."
Utifrån diagrammet ser jag att entalpin för utgångsämnena är högre än för produkterna, men jag är osäker på hur jag ska tolka det. Vilket av ämnena finns det mest av i jämviktsblandningen?
Tänker jag rätt om jag tänker att om entalpin för utgångsämnena hade varit samma som för produkterna hade förhållandet mellan dem varit 1:1?
Ja du tänker rätt. Är det endast entalpin som avgör jämvikten, och entalpin är lika för reaktant/produkt så kan du förvänta dig att förhållandet blir 1:1.
Jag ser att reaktionen är exoterm åt höger och endoterm åt vänster. Är det något jag kan använda mig av?
Ja, det kan du använda dig av för att motivera varför fördelningen inte blir 1:1. Skillnaden i entropi (liknande i diagrammet) avges ofta som värme till omgivningen, motsvarande en exoterm reaktion. Men värme kan också tas ifrån omgivningen på motsvarande vis, och på så vis ge den aktiveringsenergin som behövs för att få en molekyl av produkten att bilda utgångsämnet. Värme påverkar mer hur snabbt jämvikten ställer in sig, d.v.s. hur lång tid det tar för ämnena att regera så pass mycket att mängden reaktant står i jämvikt med produkten - m.a.o. hur snabbt jämvikten ställer in sig.
Men även om du bortser ifrån värme och tittar endast på entalpin, så kan du resonera omkring vilket ämne som det borde finnas mer av i ditt exempel. Kommer du vidare?
Tack för hjälpen!
Om utgångsämnen och produkter hade varit på linjer i samma höjd (energinivålinjer i diagram) skulle blandningen innehålla lika delar. Nu är linjen för produkter längre ner. Utgångsämnena mer energirika än produkterna
Jag har börjat fundera på den fria energin och försökt använda formeln ∆G = ∆H – T×∆S. Men det känns som att jag är fel ute. Kom på att temperaturen kanske inte är konstant eftersom reaktionen inte sker i ett slutet kärl, så det är nog fel väg att gå.
En tanke, som utgår från ett mer bildligt resonemang, är att produkterna behöver mer energi för att nå upp över aktiveringsenergin, dvs. kullen är högre om man går från höger än om man går från vänster. Färre molekyler borde ha tillräckligt med energi för att ta sig över aktiveringsenergin och därmed borde flest molekyler vara "fast" på platån (energinivån) för produkter. Det är kanske lite svårt att hänga med i mitt resonemang, men detta är det jag kan komma på.

