Förbränningsentalpi
Behöver hjälp med fråga A


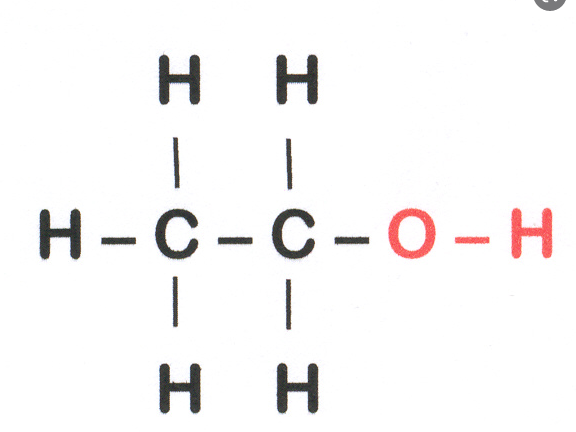
C-C=347
5*(C-H)=5*413
C-O=358
H-O=464
+347+5*413+358+464=3234
3 * O2=3*2*498 <--- Totalt 6 bindningar
C2H5OH + 3O2 = 3*2*498 + 3234 = 6222
2 * CO2 = 2*2*805
3* 2 * H-O = 3*2*464
+2*2*805 +3*2*464=6004
3234-6004=-2770 kJ
Mitt svar: Reaktionen är exoterm. Delta H = 3234-6004=-2770 kJ
Facits svar: Reaktionen är exoterm. Delta H = 4728-6004=-1276 kJ
Jag tror att jag har gjort något fel när jag räknade ut energin för syrgasen. I facit så står det (för uträkningen av syrgasens energi): 3*498 kJ. Men det borde väl vara 3*2*498 eftersom att det finns totalt 6 bindningar?
Jag tror att jag har gjort något fel när jag räknade ut energin för syrgasen. I facit så står det (för uträkningen av syrgasens energi): 3*498 kJ. Men det borde väl vara 3*2*498 eftersom att det finns totalt 6 bindningar?
Nej, det är 3 dubbelbindningar. (Det gjorde jag fel på när jag hade CP i kemi på gymnasiet - centralt prov, motsvarar nationellt prov nuförtiden ungefär - och det retar mig fortfarande.)
Smaragdalena skrev:Jag tror att jag har gjort något fel när jag räknade ut energin för syrgasen. I facit så står det (för uträkningen av syrgasens energi): 3*498 kJ. Men det borde väl vara 3*2*498 eftersom att det finns totalt 6 bindningar?
Nej, det är 3 dubbelbindningar. (Det gjorde jag fel på när jag hade CP i kemi på gymnasiet - centralt prov, motsvarar nationellt prov nuförtiden ungefär - och det retar mig fortfarande.)
Jaha, okej tack 😁


