Flerprotoniga syror
Hej !
Jag har en fråga kring flerprotoniga syror. Kan de endast reagera surt, eller mer specifik bara skapa H3O+, fast deras pKa är större än deras pKb. Om det är så undrar jag vad förklaringen är?
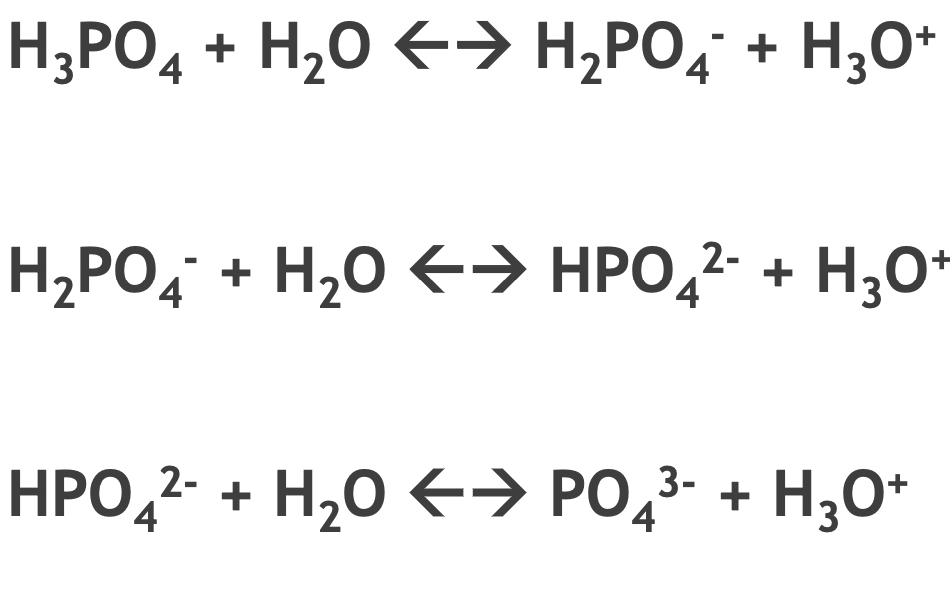
Det är specifikt denna reaktion jag funderar kring, H2Po4- har just lägre pKb än pKa.
Både divätefosfatjonen och vätefosfatjonen är amfolyter, dvs de kan fungera både som bas och syra. Fosforsyra är endast en syra medan fosfatjonen är endast en bas.
Om pKa är större än pKb för en amfolyt innebär det att om amfolyten löses i vatten så blir lösningen sur. Om pKb är större än pKa blir lösningen istället basisk. Om divätefosfatjonen har högre pKa än pKb innebär det att en vattenlösning av t.ex. natriumdivätefosfat kommer att vara sur.


