Entropi
Hej, har suttit i ett par tiotals timmar med att förstå entropi men det är inte mycket som verkar förståeligt.
Det jag inte lyckas få fram är vad det egentligen betyder att t.ex då två vattenmängder av olika temperaturer blandas så sjunker den varmas entropi och den kallas ökar. Men jag vet inte vad det innebär att entropi minskar eller ökar rent praktiskt då det inte finns något klart svar för detta?
Jag försöker rikta in mig på problemet men det finns inga tydliga svar någonstans, men det känns som att jag är så nära att förstå ändå.
Det svar jag letar efter vore för vad det innebär rent praktiskt när en entropi minskar eller ökar och blandningens entropi t.ex minskar eller ökar.
Man kan se det som ett mått på hur ”utspridd” energin är i ett system. Enligt termodynamikens andra huvudsats driver alla spontana processer mot en ökning av universums entropi (universum är systemet, dvs det man studerar + omgivningen, dvs det man inte studerar). Naturen vill alltså sprida ut energin med tiden. Att det är så är en statistisk konsekvens.
Det finns en bra liknelse där man har lika många blåa och röda identiska bollar som man lägger i en låda som man sedan skakar om. Ifall man öppnar lådan förväntar du dig nog att bollarna är jämnt blandade, eller hur? Men varför förväntar vi oss inte att alla blåa hamnar längst ner och alla röda högst upp? Det verkar orimligt, men varför är det orimligt? Rent statistiskt beror det på att det finns otroligt många sätt för bollarna att blandas på ett sätt där de ser ”jämnt blandade ut”, men det finns ganska få sätt att ordna dem med blåa längst ner och röda högst upp. Därför är det mest sannolika utfallet att man hittar bollarna jämnt fördelade när lådan öppnas.
På samma sätt fungerar det med entropin. Om vi har ett glas med ljummet vatten så rör sig vattenmolekylerna med olika hastighet. Det finns ingenting som säger att inte alla snabba molekyler kan samlas i en del av glaset (som då får en högre temperatur) medan alla långsamma molekyler samlas i en annan del av glaset (som då får en lägre temperatur). Problemet är att det är väldigt osannolikt att det ska hända, för det finns så otroligt många andra sätt för molekylerna att röra sig så att de istället är jämnt blandade.
Ok, men vad betyder det att entropin för en vätska ökar eller minskar, och vad innebär det att en blandings entropi minskar eller ökar, och vad säger egentligen den specifika entropin för ett ämne?
Att entropin minskar innebär att antalet tillstånd det kan inneha minskar. I kallt vatten rör sig molekylerna långsamt, medan de rör sig fortare i varmt vatten . Det innebär att molekylerna i varmt vatten kan inneha fler tillstånd (sprida ut energin mer) vilket gör att dess entropi är högre. Detta kanske inte är helt självklart, men du kan istället jämföra vatten med is. I isen är molekylerna nästan helt låsta på sina positioner i en kristallstruktur, vilket gör att de inte kan inneha så många olika tillstånd (de kan inte röra sig). Därför har isen mycket lägre entropi än det flytande vattnet. Kallt vatten ligger strukturellt någonstans mellan is och varmt vatten, dvs molekylerna är mer trögrörliga än i varmt vatten men inte lika fastlåsta som i is. Alltså är kallt vattens entropi någonstans mellan is och varmt vatten.
Det finns ett bättre sätt att beskriva entropin när man diskuterar värme:
Entropiändringen är alltså lika stor som värmeflödet in till ett system delat med systemets temperatur. Om vi tänker att vi har 1 kg nollgradigt vatten (T=273 K) som blandas med 1 kg 100-gradigt vatten (T=373 K) utan värmeförluster till omgivningen kommer temperaturen att bli 50 grader (323 K).
Det kalla vattnets entropi ändras med:
Det varma vattnets entropi ändras med:
Total entropiändring för denna process blir alltså
Att entropin ökar, samtidigt som vi har ett isolerat system (inget energiutbyte med omgivningen) innebär att detta är en spontan process enligt termodynamikens andra huvudsats.
Jag förstod formlerna och allt, men nu undrar jag vad det innebär med fler och färre tillstånd? Som jag antar är mikrotillstånd.
Hur ska jag tänka kring dessa tillstånd? Är dessa tillstånd platser i vattnet med olika temperaturer? Och innebär fler tillstånd att mer energi procentuellt avges?
Ja precis, det är antalet mikrotillstånd. Egentligen betyder det att du tänker dig att du kunde ta en stillbild av alla molekyler. Det är ett mikrotillstånd. Om du tar en stillbild till så är molekylerna troligen på andra platser och då har du ett till mikrotillstånd. Det finns såklart ett enormt antal mikrotillstånd så du kan inte räkna ut hur många som finns på något enkelt sätt.
Man kan idealisera antalet mikrotillstånd i vissa fall, t.ex. om vi har is som befinner sig vid absoluta nollpunkten. Då är molekylerna helt stilla (inga värmerörelser) i sin kristallstruktur vilket innebär att det bara finns ett enda mikrotillstånd. I ett sådant system är entropin noll. Detta kallas för termodynamikens tredje huvudsats.
Ok, för entropi som jag förstått, så handlar det om förlust. Avger ämnen värmeenergi snabbare vid höga temperaturer p.ga den höga entropin? Och blir det då en förlust på något vis? Och vad har entropin för praktisk funktion? Liksom varför vill jag ha något med antingen låg eller hög entropi?
Tänkte just på en sak. Är det så att entropin är högre vid höga temperaturer p.ga att den tillgängliga värmeenergin omvandlas till volymändringsarbete istället för att endast avges som värme?
Avger ämnen värmeenergi snabbare vid höga temperaturer p.ga den höga entropin?
Värme avges snabbare vid högre temperaturer men det har inget med entropin att göra. Det beror på att ledning, strömning och strålning är mer omfattande om temperaturen är hög.
Och vad har entropin för praktisk funktion? Liksom varför vill jag ha något med antingen låg eller hög entropi?
När man utvecklade begreppet entropi så höll man på att utveckla ångmaskiner under industriella revolutionen. Då behövde man entropibegreppet eftersom det påverkar saker som verkningsgrad och beskriver vilka processer som kan respektive inte kan ske.
I modern tid har man vidareutvecklat begreppet och insett hur fundamental betydelse det har för naturen i stort. Man tror t.ex. att tiden har en riktning till följd av entropin, dvs att tiden sker i den riktning som ökar universums entropi. Det kommer då att slutligen leda till slutet av universum, det man kallar värmedöden och som innebär att energin är helt utspridd i hela universum, ett slags ”maximal entropi”.
Det viktigaste att ta med sig när det gäller entropin är att det styr vad som kan respektive inte kan ske i naturen. Alla processer som är möjliga måste leda till en ökning av universums entropi. Det förklarar både varför vissa kemiska reaktioner sker respektive inte sker, varför ett hjul rullar ner för en kulle och inte tvärt om, etc etc.
Är det så att entropin är högre vid höga temperaturer p.ga att den tillgängliga värmeenergin omvandlas till volymändringsarbete istället för att endast avges som värme?
Nej, att hög temperatur innebär hög entropi har som sagt att göra med att antalet mikrotillstånd är stort vid hög temperatur. Men du är inne på något intressant. Det du beskriver är hur en värmemaskin, t.ex. en förbränningsmotor, fungerar. Det hänger ihop med entropin. Man ”stjäl” entropi från det som är varmt i en sådan maskin för att utföra ett arbete.
Ok tack
Jo i ditt exempel då 1kg varmt vatten blandas med 1kg kallt vatten, räknar man fram entropinändringen för det varma vattnet då det sjunker till 50 grader celsius? Är det inte viktigt att temperaturen för det varma vattnet hamnar på 50 grader celsius?
Hur menar du med att det är viktigt?
Jo ifall den specifika temperaturen det varma och kalla vattnet hamnar på är relevant för entropiändringen? Men såg nu i formeln "cmln(T2/T1)" att jämviktstemperaturen är relevant.
Testa att räkna på det!
Det jag undrar nu är varför entropiändringen inte är lika stor vid olika temperaturdifferenser.
Exempel är att vi har 4180*1*ln(323/373) men detta är ju inte lika med 4180*1*ln(330/380) även om temperaturdifferensen är lika stor. Jag kan se rent matematiskt varför det inte stämmer men om man tittar förbi det matematiska och kollar efter varför entropiändringen blir annorlunda vid olika temperaturer med samma temperaturdifferens, beror detta på att entropin är olika vid olika specifika temperaturer? Men detta innebär ju att entropin ökar inte konstant utefter t.ex då vattnets temperatur ökar, utan rentav så avtar entropiändringen då t.ex temperaturen för vatten ökar och hamnar sedan på en lägre temperatur medan temperaturdifferensen fortfarande är lika stor.
Exempel: ln(150/200)>ln(350/400) men temperaturskillnaden är lika stor.
Och då undrar jag ju då, rent fysikaliskt och logiskt, varför entropiändringen blir mindre och mindre ju högre entropin blir?
Och det innebär ju att grafen för entropin har en derivata som går mot +0 ju högre temperaturen blir och det är, förmodligen, en logaritmisk funktion.
Bra observation! Det är ganska krångligt och hänger ihop med kvantmekanik och hur energi fördelas i en molekyl. Man kan säga att om temperaturen är låg kan extra energi spridas ut över molekylen i större utsträckning, dvs antalet möjliga mikrotillstånd ökar mer när temperaturen är låg jämfört med när temperaturen är högre.
Aha ok, men tack för all din hjälp! Nu känner jag att jag snart kan börja räkna på det här, känns ju inte bra om man inte vet vad man gör liksom haha.
Tror inte att man räknar så mycket på entropi i gymnasiefysiken, så det vi har diskuterat i den här tråden är nog överkurs. Men redan nu kan du räkna på enklare fall.
Låt säga att vi har en frysbox med volymen 1 m3 som bara innehåller 25-gradig luft (rumstemperatur). Vi kan beräkna hur mycket energi som krävs för att kyla ner luften i frysboxen till -20 grader:
Entropiändringen för luften i frysen blir då:
Om vi försummar nedkylning av själva frysen (vi antar att man öppnar och stänger frysen så att själva frysen redan är kall) så kommer 58 050 J att transporteras bort ut i rummet, enligt termodynamikens första huvudsats (energin bevaras). Om vi antar en konstant temperatur i rummet på 25 grader så blir rummets entropiändring:
Nu kan vi beräkna universums entropiändring, dvs summan av entropiändringarna för systemet (luften i frysen) och omgivningen (rummet):
Här ser du att universums entropiändring blir negativ, vilket gör att termodynamikens andra huvudsats (ökning av universums entropi för spontan process) förbjuder denna process, dvs nedkylning av luften, från att ske. Det begriper vi också rent intuitivt för luften kyls inte bara ner utan att vi gör något. Det är här strömkabeln till frysen kommer in i bilden, dvs vi måste tillföra extra energi för att detta ska bli en spontan process. Uttryckt annorlunda så måste vi föra ut mer värme i rummet så att dess entropi ökar ännu mer.
Kan du försöka beräkna hur mycket extra energi (värme) vi i minsta fall behöver föra ut i rummet för att frysen ska fungera?
Ok, jag ska sätta mig in i den där nu
Men om luften i frysen har avgett energi till frysen vad händer då med den energin? Och när luften i frysen åker ut i rummet borde inte då den kalla luften sänka rummets temperatur så varför säger man att det förs ut energi i rummet och inte inte negativ energi som kommer ta energi från rummet?
Den kalla luften som släpps ut värms upp spontant, men det är inte relevant för den här uppgiften.
Värmet som luften i frysen avger leds ut i rummet där frysen står.
Jahaaa, så den kalla luften i frysen är kvar i frysen?
Jag antar att en frys fungerar på det sättet att den inte ska kyla ned eller värma upp rummet. Så därför behöver ca 4800J extra föras ut i rummet från externa medier.
Så att totala energin ut i rummet blir ca 62900J.
Eller watt borde det vara väl?
Men något jag inte förstår är att varför processen inte fungerar utan strömkabeln?
Är det så att frysen avger mindre energi än vad rummet tar upp? Varför blir det i sådana fall på det viset? Energin förs ju bort från luften i frysen på något vis för att sedan föras ut i rummet. Energin bevaras.
SuperCrazyFlipper skrev:Jahaaa, så den kalla luften i frysen är kvar i frysen?
Då kan föreställa dig att vi har en frysbox där luften inne i frysen håller rumstemperatur, samt att vi försummar nedkylning av själva väggarna i frysen när vi gör våra beräkningar vid nedkylning av luften. Är det realistiskt? Nej, men jag lovar dig att slutsatsen hade blivit samma även om vi hade krånglat till det och tagit med nedkylning av väggarna i beräkningarna.
SuperCrazyFlipper skrev:Jag antar att en frys fungerar på det sättet att den inte ska kyla ned eller värma upp rummet. Så därför behöver ca 4800J extra föras ut i rummet från externa medier.
Så att totala energin ut i rummet blir ca 62900J.
Eller watt borde det vara väl?
Helt riktigt! Om man för ut minst 4,8 kJ extra ut i rummet så blir universums entropiändring större än noll och då är det möjligt att kyla ner luften i frysen till -20 grader.
Det är joule som är enheten, eftersom det är en energi vi beräknar. Men ju högre effekt, desto snabbare sker nedkylningen.
SuperCrazyFlipper skrev:Men något jag inte förstår är att varför processen inte fungerar utan strömkabeln?
Är det så att frysen avger mindre energi än vad rummet tar upp? Varför blir det i sådana fall på det viset? Energin förs ju bort från luften i frysen på något vis för att sedan föras ut i rummet. Energin bevaras.
Precis, det förs ut mer energi i rummet än vad som förs ut från frysen. Man kan sammanfatta energibalansen som:
Värme från nedkylningen + elektrisk energi från strömkabeln = Värme ut i rummet
Anledningen till att det krävs extra energi beror som sagt på entropin. Man kan se det som att luften i frysen blir mer ordnad vid nedkylningen, medan den mer oordnade luften i rummet inte räcker till för att göra universum i sin helhet "mer oordnat". Man måste då tillföra "ordnad energi" i form av elektrisk energi och släppa ut den i rummet som värme för att oordningen i sin helhet ska öka. Med "oordnad" menas alltså att energin blir mer utspridd.
När det gäller "ordnad energi" finns ett begrepp för det - exergi:
https://sv.wikipedia.org/wiki/Exergi
Det är precis samma naturlag som driver en frysbox som möjliggör livet på jorden. För att en biologisk varelse ska kunna bygga upp och reparera sin kropp behöver den bygga upp avancerade makromolekyler som DNA, proteiner, kolhydrater etc. Detta är väldigt ordnade strukturer som leder till en ökning av entropin vid deras bildande. Ibland säger man lite slarvigt att "solenergin driver livet på jorden", men det är egentligen fel. Jorden strålar med tiden ut lika mycket energi som den tar emot från solen. Det som däremot händer är att jorden "stjäl" entropi från solen. Växter tar emot "ordnad solenergi", energin släpps sedan ut som värme och leder till en ökning av entropin. Det är denna entropiökning som utnyttjas av levande varelser för att kunna bygga upp alla komplexa molekyler.
Om vi liknar detta med frysboxen så motsvarar nedkylning av luften att bygga upp avancerade molekyler, solenergin motsvarar den elektriska energin och värmet som strålar ut i rymden motsvarar värmet som strålar ut i rummet.
Så du måste tillföra energi för att starta den spontana processen? Om jag förstått det rätt.
Och eftersom systemets entropi hade minskat så hade ifall vi överför dem där 58050 joulen från rummet in i frysen igen, rummets temperatur varit högre än 25 grader celsius?
Men varför ökar rummets entropi mindre än vad frysens luft minskar? Varför blir det så och hur vet man i förväg att det kommer bli så? Varför blir det inte så när man t.ex blandar vatten av olika temperaturer med varandra?
Så du måste tillföra energi för att starta den spontana processen? Om jag förstått det rätt.
Det är snarare så att processen blir spontan om man tillför den extra energin. Utan extra energi är den icke-spontan, vilket är ett finare sätt att säga att det inte sker. Notera att det i teorin inte betyder att det är fysisk omöjligt, men det är så ofantligt osannolikt att du säkert skulle kunna vänta i biljoner år utan att observera det.
Och eftersom systemets entropi hade minskat så hade ifall vi överför dem där 58050 joulen från rummet in i frysen igen, rummets temperatur varit högre än 25 grader celsius?
Jag vet inte hur du menar här, men tar du bort energi från rummet så blir rummet kallare och då minskar dess entropi medan hos för luften i frysboxen ökar. Testa att räkna på det så ser du om det är en spontan process eller inte. Men rent intuitivt kanske du redan vet vad som händer med temperaturen i en frys om man kopplar ur sladden och låter den stå i rumstemperatur?
Men varför ökar rummets entropi mindre än vad frysens luft minskar? Varför blir det så och hur vet man i förväg att det kommer bli så? Varför blir det inte så när man t.ex blandar vatten av olika temperaturer med varandra?
Det är inte alls självklart vad som sker och inte sker spontant, men som tur är kan man räkna på det. Men det som gör processen med frysboxen icke-spontan utan den extra energin är att man skapar temperaturskillnader mellan något som hade samma temperatur från första början. Naturen strävar efter att jämna ut sådana skillnader. Molekylerna i något som är varmt rör sig snabbare än molekylerna i något som är kallt. Med tiden kommer molekylerna att knuffa i varandra (eller blandas runt om det är möjligt, t.ex. om två vätskor kommer i kontakt med varandra) och fördela energin mellan sig så att den till slut är jämnt fördelad, dvs de får samma temperatur.
Så sladden tillför energi in till frysen så att luften blir varmare? Eller tillför sladden energi direkt ut i rummet?
Teraeagle skrev:Så du måste tillföra energi för att starta den spontana processen? Om jag förstått det rätt.
Det är snarare så att processen blir spontan om man tillför den extra energin. Utan extra energi är den icke-spontan, vilket är ett finare sätt att säga att det inte sker. Notera att det i teorin inte betyder att det är fysisk omöjligt, men det är så ofantligt osannolikt att du säkert skulle kunna vänta i biljoner år utan att observera det.
Och eftersom systemets entropi hade minskat så hade ifall vi överför dem där 58050 joulen från rummet in i frysen igen, rummets temperatur varit högre än 25 grader celsius?
Jag vet inte hur du menar här, men tar du bort energi från rummet så blir rummet kallare och då minskar dess entropi medan hos för luften i frysboxen ökar. Testa att räkna på det så ser du om det är en spontan process eller inte. Men rent intuitivt kanske du redan vet vad som händer med temperaturen i en frys om man kopplar ur sladden och låter den stå i rumstemperatur?
Men varför ökar rummets entropi mindre än vad frysens luft minskar? Varför blir det så och hur vet man i förväg att det kommer bli så? Varför blir det inte så när man t.ex blandar vatten av olika temperaturer med varandra?
Det är inte alls självklart vad som sker och inte sker spontant, men som tur är kan man räkna på det. Men det som gör processen med frysboxen icke-spontan utan den extra energin är att man skapar temperaturskillnader mellan något som hade samma temperatur från första början. Naturen strävar efter att jämna ut sådana skillnader. Molekylerna i något som är varmt rör sig snabbare än molekylerna i något som är kallt. Med tiden kommer molekylerna att knuffa i varandra (eller blandas runt om det är möjligt, t.ex. om två vätskor kommer i kontakt med varandra) och fördela energin mellan sig så att den till slut är jämnt fördelad, dvs de får samma temperatur.
Vad som borde hända i frysen är att den och rummet kommer till slut få samma temperatur?
SuperCrazyFlipper skrev:Så sladden tillför energi in till frysen så att luften blir varmare? Eller tillför sladden energi direkt ut i rummet?
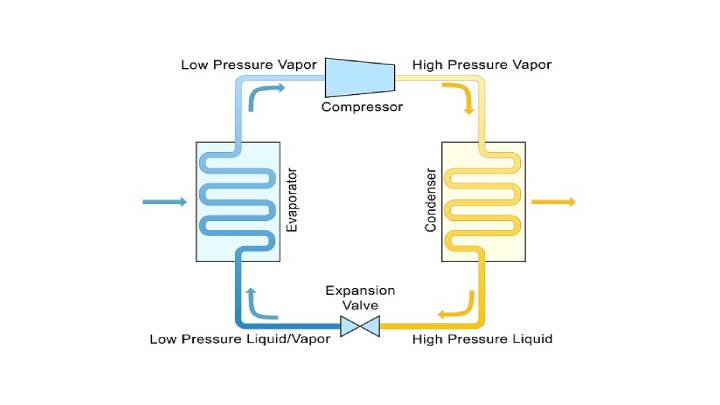
Energin hamnar slutligen i rummet (inte i frysen, då skulle ju luften där inne värms upp). Den går inte "direkt" ut i rummet utan elen driver en kompressor som komprimerar ett köldmedium, som då värms upp och avger värme till rummet, sedan expanderar och då kyler ner frysen. Sedan återvänder köldmediet till kompressorn och cykeln upprepas.
Vad som borde hända i frysen är att den och rummet kommer till slut få samma temperatur?
Ja precis, det leder till en positiv entropiändring att leda värme in i frysen så den kommer till slut få samma temperatur som rummet (hur snabbt det sker beror på hur bra isolerad frysen är).
En stor fråga är ju den att varför det blir en entropiskillnad och vad en negativ entropiskillnad betyder
Jag förstår dock, tror jag, att luften i frysen avger energi vid 25 grader celsius för att minska till -20 grader celsius och en del av den energin går förlorad p.ga entropin. Eller är det så att frysen, utan kabeln, fortfarande avger 58050 Joule och rummet tar upp 58050 Joule? För då bevaras energin i systemet.
Just det, köldmediet i kompressorn måste få samma höga temperatur om och om igen eller hur? Och då den når sin högsta temperatur så sker denna förlust av energi då den expanderar och då måste denna förlust tillföras genom elkabeln, samtidigt som energi förmodligen tillförs för att driva kompressorn också? Om det verkar stämma någorlunda.
Dock är jag nyfiken på vart den förlorade energin försvinner för att hålla energin bevarad?
Det är ingen energi som försvinner. Värme förs ut från frysen ut i rummet. Formellt leder det till att rummet värms upp, men om rummet är stort kan man anta att temperaturen är någorlunda konstant.
Men enligt så får du ut just den energin, vad häner med resten? Förresten stämde den där uppfattningen jag hade om köldmediet?
Dock så säger boken, om entropi, helt andra saker. I värmemaskinen så tillförs värme för att sedan efter expandering bortföras för att sedan komprimeras.
Problemet jag märker är att jag trodde att den bortförda värmen var den nyttiga energin. Men det verkar som att enligt boken så tar du för att få den nyttiga energin, dock den energin är ju den energi du har kvar i värmemaskinen, inte den värme som bortförs.
T.ex om du tillför 100J värme och maskinen för bort 75J värme, borde inte verkningsgraden vara 75% då? Men enligt den där formeln så ska verkningsgraden bli .
Läste lite och är det så att dem definierar verkningsgraden som den andel som inte kan bli till värmeenergi?
Förresten stämde den där uppfattningen jag hade om köldmediet?
Inte riktigt. När köldmediet förångas och expanderar så kyls det ner, vilket gör att värme tas från frysen för att värma upp köldmediet igen. Det nu uppvärmda köldmediet komprimeras sedan och kondenserar vilket gör att det värms upp. Denna överskottsvärme avges till luften i rummet via en värmeväxlare. Sedan sänks trycket igen så att köldmediet kokar och cykeln upprepas.
Dock så säger boken, om entropi, helt andra saker. I värmemaskinen så tillförs värme för att sedan efter expandering bortföras för att sedan komprimeras.
En frysbox fungerar inte som en värmemaskin, en värmemaskin är t.ex. en förbränningsmotor som utnyttjar ett värmeflöde för att uträtta arbete. En "omvänd värmemaskin" som en frysbox utför ett arbete för att skapa ett värmeflöde.
Man kan inte beräkna verkningsgraden (i traditionell mening) för en omvänd värmemaskin, utan man pratar istället om något som kallas "coefficient of performance":
Beror nedkylningen på minskning av trycket? Och just när köldmediet kondenserat hur kan det öka i temperatur igen utan att förångas igen?
Det jag undrade kring verkningsgrad centrerade kring just värmemaskiner.
I det här exemplet så framstår det som att ju mer bortförd värmeenergi ju lägre verkningsgrad. Men det är väl mer bortförd värmeenergi man vill ha väl? Eller är det inget som tar upp den där bortförda värmen?
Nej, i en värmemaskin vill man inte ha bortförd energi. Man vill att så mycket av den tillförda energin som möjligt omsätts i arbete. Den teoretiskt maximala verkningsgraden för en värmemaskin ges av något som kallas Carnot-cykel:
Teraeagle skrev:Nej, i en värmemaskin vill man inte ha bortförd energi. Man vill att så mycket av den tillförda energin som möjligt omsätts i arbete. Den teoretiskt maximala verkningsgraden för en värmemaskin ges av något som kallas Carnot-cykel:
Jaha, menar de att den bortförda värmeenergin är en förlust då? Att det inte finns något som tar upp den? Är det turbinen som tar upp energi?
Ja, bortförd energi är en förlust i en värmemaskin. Eller kan vara det. Säg att du har ett kraftverk som eldar ett bränsle för att koka vatten, sedan låter man ångan driva en turbin kopplad till en generator som alstrar ström. Då är strömmen "nyttig energi", men det bortförda värmet som inte blir till elenergi skulle man kanske kunna använda för att göra fjärrvärme. Då är det också en form av "nyttig energi" i ingenjörsmässig mening, även om det inte är det rent fysikaliskt.
Ahaaa, då förstår jag! Den där har legat och gnagt i huvudet hela tiden märker jag nu.
Bara för att få det hela klart, är det i turbinen man får elektrisk energi från värmen? Enligt den värmemaskinen jag skickade bild på?
Ja, en turbin kan du tänka är som en stor roterande propeller som man kan koppla till en elgenerator. Det är generatorn som alstrar ström.
Ja ok, då blir det hela mycket mer logiskt! Tack för all hjälp, nu kan jag börja räkna här!