Dipoler
Jag vet att en dipol är en osymmetriskt molekyl med polära kovalenta bindningar problemet är att jag har inte riktigt förstått definitionen av ordet osymmetriskt
Kan någon förklara vad osymmetriskt respektive symmetriskt betyder inom kemi ?
Ta t.ex. vattenmolekylen H2O som är en osymmetrisk molekyl. Det sättet elektronerna ordnat sig på för att komma så långt ifrån varandra (repellera varandra) bidrar till en laddningsförskjutning hos hela molekylen. Pga. den polära kovalenta bindningen mellan väte och syre kommer en något mer positiv laddning äga rum på ena sidan av molekylen samtidigt som de två fria elektronpar som syrets två fria elektronpar kommer befinna sig på "andra sidan" av syreatomen. Laddningen blir alltså inte jämn fördelad över vattenmolekylen och då säger vi att den är osymmetrisk.
Jämför detta med t.ex. Metan CH4. Lika så här kommer de kovalenta bindningarna bidra till att en något mer positiv laddning äger rum vid väte samt att syre får en något negativare laddning. Fortfarande kallar vi metan för en symmetrisk molekyl. Detta är för att det finns fyra väteatomer som binder sig till syreatomen på så sätt att de hamnar så långt ifrån varandra som möjligt, som en tetraeder. Den totala laddningens "tyngdpunkt" hamnar därför precis i centrum av molekylen så det finns ingen positivt resp. negativt laddad "sida" på metan. Vi säger att metan är en symmetrisk molekyl.
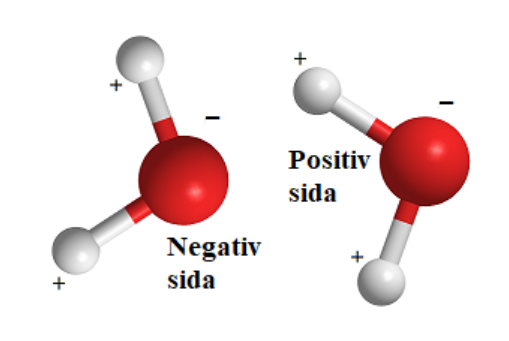

Här kan du se en vattenmolekyl resp. metalmolekyl. (Metan är den svartvita)
Groblix skrev:Ta t.ex. vattenmolekylen H2O som är en osymmetrisk molekyl. Det sättet elektronerna ordnat sig på för att komma så långt ifrån varandra (repellera varandra) bidrar till en laddningsförskjutning hos hela molekylen. Pga. den polära kovalenta bindningen mellan väte och syre kommer en något mer positiv laddning äga rum på ena sidan av molekylen samtidigt som de två fria elektronpar som syrets två fria elektronpar kommer befinna sig på "andra sidan" av syreatomen. Laddningen blir alltså inte jämn fördelad över vattenmolekylen och då säger vi att den är osymmetrisk.
Jämför detta med t.ex. Metan CH4. Lika så här kommer de kovalenta bindningarna bidra till att en något mer positiv laddning äger rum vid väte samt att syre får en något negativare laddning. Fortfarande kallar vi metan för en symmetrisk molekyl. Detta är för att det finns fyra väteatomer som binder sig till syreatomen på så sätt att de hamnar så långt ifrån varandra som möjligt, som en tetraeder. Den totala laddningens "tyngdpunkt" hamnar därför precis i centrum av molekylen så det finns ingen positivt resp. negativt laddad "sida" på metan. Vi säger att metan är en symmetrisk molekyl.
Hur bestämmer man centrum på de negativa och positiva laddningar i molekylen ?

