Dipol
Hej, förstår inte hur man ska lösa denna fråga för hur räknar man på elektronegativiteten när det finns både C,H och flertalet Cl atomer? Skulle uppskatta hjälp
Just att det är olika atomer, med olika elektronegativitet gör att det är möjligt att få en dipol.
Alla molekyler i din uppgift har formen av en tetraheder, och med endast en typ av atom, kan inte en dipol bildas.
Men i och med att atomerna har olika elektronegativitet, så kommer elektronerna dras från vissa atomer, till andra, och genom förskjutningen av elektronernas fördelning uppstår dipolen.
mag1 skrev:Just att det är olika atomer, med olika elektronegativitet gör att det är möjligt att få en dipol.
Alla molekyler i din uppgift har formen av en tetraheder, och med endast en typ av atom, kan inte en dipol bildas.
Men i och med att atomerna har olika elektronegativitet, så kommer elektronerna dras från vissa atomer, till andra, och genom förskjutningen av elektronernas fördelning uppstår dipolen.
Varför är CHCL3 en dipol?
mellan kolet och vätet = 2,5-2,1 = 0,4 (dvs opolär kovalent)
mellan kolet och kloret= 3-2,5= 0,5 (dvs precis mot gränsen till polär?)
och det står att CCl4 betraktades som dipol, men mellan kol och klor var det ju 0,5 (dvs precis mot gränsen mot polär) varför är den då inte en dipol?
Är det för att deras delta-neg tar ut varandra? eller finns det en annan förklaring?
och det står att CCl4 betraktades som dipol, men mellan kol och klor var det ju 0,5 (dvs precis mot gränsen mot polär) varför är den då inte en dipol?
Nej det står precis tvärt om.
Är det för att deras delta-neg tar ut varandra? eller finns det en annan förklaring?
Ja precis CCl4 har en tetraedral form, med de negativa dipolerna vid kloratomerna i varsitt hörn av tetraedern. Det gör att de delta-negativa laddningarna (från dipolerna vid kloren) tillsammans sammanfaller i mitten, precis där den delta-positiva laddningen finns.
mag1 skrev:och det står att CCl4 betraktades som dipol, men mellan kol och klor var det ju 0,5 (dvs precis mot gränsen mot polär) varför är den då inte en dipol?
Nej det står precis tvärt om.
Oj, jag skrev fel. Men, varför är den inte en dipol? är det för 0,5 innebär att det är en kovalent bindning?
Ja precis CCl4 har en tetraedral form, med de negativa dipolerna vid kloratomerna i varsitt hörn av tetraedern. Det gör att de delta-negativa laddningarna (från dipolerna vid kloren) tillsammans sammanfaller i mitten, precis där den delta-positiva laddningen finns.
Hur blir det med de två sista?
1. Bör inte CH2CL2 bli kovalent då de två Cl tar ut varandra och de två H tar ut varandra?
och CH3Cl
2. där är ju skillnaden mellan kol och väte 0,4 och skillnaden mellan klor och kol 0,5 - alla dessa värden är väl kovalenta? eller räknas alltså 0,5 som polär kovalent? för det står
mellan 0,5-1,7 är bindningen polär kovalent men sen går gränsen > 0,5 som opolär kovalent.
så man kan alltså dra slutsatsen att den är svagt polär kovalent och därmed förblir hela molekylen dipol?
naturnatur1 skrev:mag1 skrev:och det står att CCl4 betraktades som dipol, men mellan kol och klor var det ju 0,5 (dvs precis mot gränsen mot polär) varför är den då inte en dipol?
Nej det står precis tvärt om.
Oj, jag skrev fel. Men, varför är den inte en dipol? är det för 0,5 innebär att det är en kovalent bindning?
Det finns bara en bindningstyp, C-Cl, och samtliga bindningar är polärt kovalenta, just p.g.a. elektronegativitetsskillnaden.
Men koltetrakloriden är helt symmetrisk. Den har formen av en tetraeder, med en kloratom i varje hörn av tetraedern. Så även om kloratomerna är delta-negativa så sammanfaller deras negativa dipol i mitten av tetraedern, precis där den positiva dipolen (kolatomen) är. D.v.s. den negativa och den positiva dipolen sammanfaller i samma punkt, och tar ut då ut varandra.
Ja precis CCl4 har en tetraedral form, med de negativa dipolerna vid kloratomerna i varsitt hörn av tetraedern. Det gör att de delta-negativa laddningarna (från dipolerna vid kloren) tillsammans sammanfaller i mitten, precis där den delta-positiva laddningen finns.
Hur blir det med de två sista?
1. Bör inte CH2CL2 bli kovalent då de två Cl tar ut varandra och de två H tar ut varandra?
Prova att rita upp molekylens struktur, och se efter var dipolerna hamnar, och som det står i uppgiften samtliga molekyler har tetraedral form.
Om bindningen är av polär kovalent typ, kan det bli en dipol, men ämnets struktur spelar även roll. För om dipolerna sammanfaller i samma punkt, tar de ut varandra, och ämnet är inte polärt.
och CH3Cl
2. där är ju skillnaden mellan kol och väte 0,4 och skillnaden mellan klor och kol 0,5 - alla dessa värden är väl kovalenta? eller räknas alltså 0,5 som polär kovalent? för det står
mellan 0,5-1,7 är bindningen polär kovalent men sen går gränsen > 0,5 som opolär kovalent.
så man kan alltså dra slutsatsen att den är svagt polär kovalent och därmed förblir hela molekylen dipol?
Skillnaden i elektronegativitet mellan kol och väte är precis på gränsen för om bindningen anses vara polärt kovalent (har jag för mig), och C-H bindningen betraktas oftast som "bara kovalent". Så i detta fall avgör, frånsett molekylens form, främst bindningen mellan C-Cl.
Det finns bara en bindningstyp, C-Cl, och samtliga bindningar är polärt kovalenta, just p.g.a. elektronegativitetsskillnaden.
Men koltetrakloriden är helt symmetrisk. Den har formen av en tetraeder, med en kloratom i varje hörn av tetraedern. Så även om kloratomerna är delta-negativa så sammanfaller deras negativa dipol i mitten av tetraedern, precis där den positiva dipolen (kolatomen) är. D.v.s. den negativa och den positiva dipolen sammanfaller i samma punkt, och tar ut då ut varandra.
Okej då är jag med
Prova att rita upp molekylens struktur, och se efter var dipolerna hamnar, och som det står i uppgiften samtliga molekyler har tetraedral form.
Om bindningen är av polär kovalent typ, kan det bli en dipol, men ämnets struktur spelar även roll. För om dipolerna sammanfaller i samma punkt, tar de ut varandra, och ämnet är inte polärt.
Jag ritade CH2CL2 som
H
CL - C - CL
H
tar inte de ut varandra då? eller hur vet man hur man ska rita? och hur är det en dipol? (jag skulle säga att de sammanfaller i samma punkt enligt min molekylstruktur jag ritat upp, men den kanske är fel? hur vet jag så jag ritar rätt?)
Skillnaden i elektronegativitet mellan kol och väte är precis på gränsen för om bindningen anses vara polärt kovalent (har jag för mig), och C-H bindningen betraktas oftast som "bara kovalent". Så i detta fall avgör, frånsett molekylens form, främst bindningen mellan C-Cl.
Molekylen: CH3Cl ritade jag som
H
H - C - H
CL
och då är bindningen mellan C-H = 0,4, dvs är den opolär kovalent.
Men bindningen mellan C-CL = 0,5 dvs precis mot gränsen till polär kovalent bindning där kloret drar hårdare med högre elektronegativitet dvs centrum blir där och därför är den en dipol?
är det rätt?
______________________________
Hur ska jag veta hur jag ska rita molekylen? För som du sa så spelar ju molekylen struktur även roll.
För att direkt se stereokemin i en strukturformel är det bra rita ut bindningarnas riktning. Som du har ritat syns det hur atomerna binder till varandra, men det är endast i två dimensioner. Molekylerna har tetraedral form, så minst två bindningar kommer att "sticka upp" respektive "peka ner", motsvarande diklormetan:

Här ser du direkt att klora-kol-klor bindningarna ligger i samma plan (samma två dimensioner), och vätet längst till vänster pekar ner, och vätet mer i mitten pekar upp.
Om du tittar då strukturen av diklormetal, och tänker dig att kloratomerna drar åt sig elektroner, och elektroner dras ifrån vätena, så blir det nog enklare att se var delta-plus, respektive delta-minus polerna hamnar.
mag1 skrev:För att direkt se stereokemin i en strukturformel är det bra rita ut bindningarnas riktning. Som du har ritat syns det hur atomerna binder till varandra, men det är endast i två dimensioner. Molekylerna har tetraedral form, så minst två bindningar kommer att "sticka upp" respektive "peka ner", motsvarande diklormetan:
Här ser du direkt att klora-kol-klor bindningarna ligger i samma plan (samma två dimensioner), och vätet längst till vänster pekar ner, och vätet mer i mitten pekar upp.
Om du tittar då strukturen av diklormetal, och tänker dig att kloratomerna drar åt sig elektroner, och elektroner dras ifrån vätena, så blir det nog enklare att se var delta-plus, respektive delta-minus polerna hamnar.
Varför ritar man ut bindningen sådär (markerade med blå och röd)? Och hur ska jag veta hur den korrekta strukturen ser ut på ex prov? för jag trodde den såg ut som jag skrev ovan.
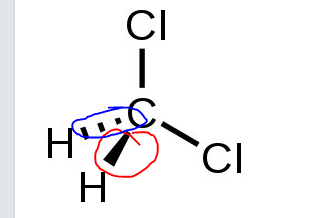
________________________________________________________
Tänker jag rätt?
 skillnad mellan H-C = 0,4 (röd text) - kovalent
skillnad mellan H-C = 0,4 (röd text) - kovalent
Skillnad mellan C-Cl = 0,5 (röd text) - precis opolär kovalent där klor drar starkare så (blå prick) blir centrum och där finns delta-neg, sen (gul markering) där blir det delta-pos för den är svagare?
Bindningarna ritas ut som streckade kilar (blå) för att visa att bindningen slutar under planet (det tänkta plan i 2D som utgörs, i detta fall, av bindningarna mellan Cl-C-Cl). Och med fyllda kilar (röd) för att visa att bindningen slutar ovanför planet. På så vis kan stereokemisk information fås med i bilden av strukturen, till skillnad från om alla bindningar endast visas i 2D. Figuren innehåller på så vis mer (relevant) information.
Och polerna du ritat ut ser bra ut.
mag1 skrev:Bindningarna ritas ut som streckade kilar (blå) för att visa att bindningen slutar under planet (det tänkta plan i 2D som utgörs, i detta fall, av bindningarna mellan Cl-C-Cl). Och med fyllda kilar (röd) för att visa att bindningen slutar ovanför planet. På så vis kan stereokemisk information fås med i bilden av strukturen, till skillnad från om alla bindningar endast visas i 2D. Figuren innehåller på så vis mer (relevant) information.
Och polerna du ritat ut ser bra ut.
okej tack. vad menar du med "ovanför planet" eller "under planet"?
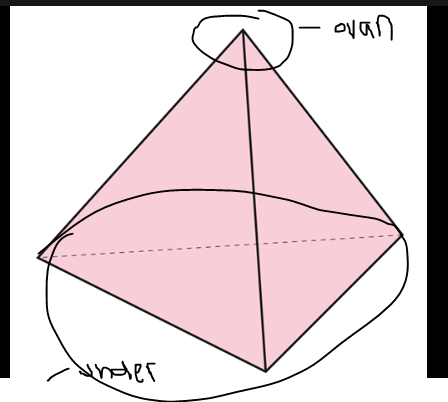
menar du så?
Nej "planet" blir ett tänkt snitt genom molekylen, oftast med en eller flera atomer i samma plan. Liknande att du tänker dig att atomerna och bindningarna mellan Cl-C-Cl, är ritade på ett papper (som motsvarar planet). Och då hamnar ena vätet under planet (sticker ner, ser du med den streckande kilen) och det andra ovanför planet.
I bilden nedan illustreras plan (eller två plan) med grå rektangel:

I bilden visas diklorometan i C. Det går att tänka sig två olika plan, ett mellan Cl-C-Cl (horisontellt, som i den bild jag visade) samt ett till plan H-C-H (vertikalt).
mag1 skrev:Nej "planet" blir ett tänkt snitt genom molekylen, oftast med en eller flera atomer i samma plan. Liknande att du tänker dig att atomerna och bindningarna mellan Cl-C-Cl, är ritade på ett papper (som motsvarar planet). Och då hamnar ena vätet under planet (sticker ner, ser du med den streckande kilen) och det andra ovanför planet.
I bilden nedan illustreras plan (eller två plan) med grå rektangel:
I bilden visas diklorometan i C. Det går att tänka sig två olika plan, ett mellan Cl-C-Cl (horisontellt, som i den bild jag visade) samt ett till plan H-C-H (vertikalt).
Aha okej. asså såhär? (:

Nej för det tänkta planet inkluderar kolatomen, som sitter exakt i mitten av tetraedern, d.v.s. planet måste inkludera mitten av tetraedern.
Bilden i inlägg #12, visar planen med kolatomen, samt två andra atomer i planet. Din tetraeders sidor, motsvarar en tänkt yta mellan t.e.x Cl-H-H i (B).

