denaturera proteiner
Jag har gjort en labb där vi undersöker olika faktorer som denaturerar proteiner. Men uppvärmningen denaturera mest medan basen gjorde det minst men varför? Jag tror att alla bindningar bryts i den som värms medan de endast är jon bindningen i prov röret med basen.
Effekterna beror till stor del på vilken protein denatureras. Vilken/vilka har ni testat?
Jag tror proteinet var äggvita.
Äggvit består av flera proteiner med lite mer än 50% Ovalbumin.
Nu vet vi ju alla att man kan koka och att de blir hårda :)
Temperaturen för denaturering av Ovalbumin är 84 grad.
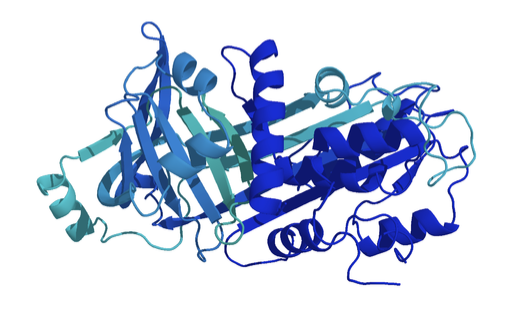
Ovalbumins struktur består av olika delar med fasta struktur som alfa helix (de skruvade strukturer i bilden) och beta-sheets (de randiga strukturer) och delar i mellan utan fast struktur som lös snöre.
Proteinet har olika bindningar
- kovalenter bindningar mellan atomer (speciellt amidbindningen i proteinkedjan som är den kovalenta bindning som är lättast att bryta)
- vätebindningar
- attraktion mellan vid pH7 laddade protonerade aminogrupper eller deprotonerade syregrupper i aminosyrors sidokedjor.
Alla bindningar går att brytas med tillräcklig hög temperatur och även med tillräcklig stark bas.
Men här vill ni antagligen undersöker "denaturering" vilken är förändring av strukturen som leder till att den "klumpas" här.
Vad händer med högre temperatur upp till 100°C:
Svagaste binding är vätebindningar och joninteraktioner. De bryts vid den temperaturen, alfa-helix och beta-sheets och därmed proteinets struktur förstörs och det blir en "klump":
Äggen är kokt och proteiner denaturerade
Vad händer med basen?
sidokedjors amino-grupper blir neutrala och fler carboxygrupper blir laddade.
De bidrar dock inte till de viktiga strukturbildande elementer alfa-helix och beta-sheet och verkar inte spelar så stor roll i äggvitas proteiner.
Kan du bildar härifrån ett eget svar?
Består proteinet (äggvitan) av både alfa-helix och beta-flak? För proteiner består väl endast av alfa aminosyror alltså är det inte bara alfa helix då eller det kanske inte är nödvändigt.
Jag har intrycket att du kan har blandat ihop några saker.
Äggvita är en blandning av många olika sorter av proteiner.
(Ett gammaldags namn för protein är äggvita)
Proteinet (en lång kedja av aminosyror som är kopplad ihop med amidbindningar) som finns mest i äggvita är/heter ovalbumin.
Bilden nedan är en representation av ovalbumins struktur. Som du ser finns det både elementer för regelbunden struktur, alfa-helix ("skruvor") och beta-sheets ("breda pilarna") samt ostrukturerad proteinkedjor ("lös snöre").
Ordet alfa används i många samband. Alfa är första bokstaven i grekiska alfabet och används därför ofta i meningen av första. Alfa-aminosyror har en aminogrupp i alfa-position (på samma C).
Det låter nästan liknande men är absolut inte samma:
Alfa -helix och beta-sheet är de två viktigaste strukturelement hur en proteinkedja kan anordna sig tredimensionalt.
Kan du hitta denna strukturer i bilden?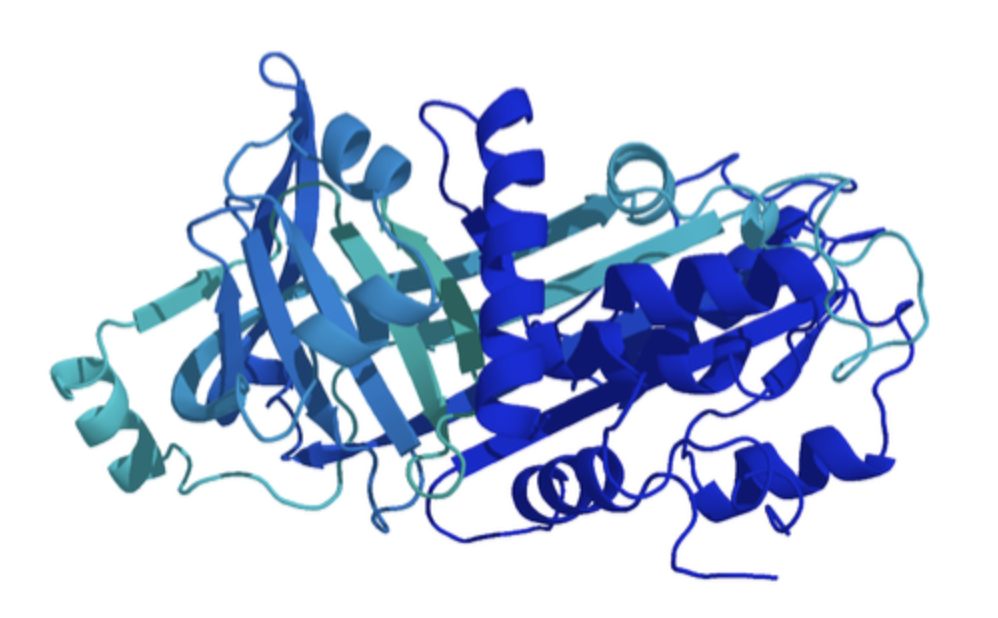
I självaste teorin på en labbrapport, ska man ha med bilder på det man pratar om t.ex. ovalbumin? Och ovalbumin det består väl av globulärt protein men finns det liksom en förklaring. För jag hittar bara på wikipedia att det är så men inte varför, dessutom tycker min lärare inte om att man använder wikipedia men jag hittar ju inget annat ställe...
Det brukar finnas länkar till "bättre" källor i Wikipediaartiklarna.
Ovalbumin ingår i gruppen globulärar proteiner (ja, vad är en globulär protein? tipps... globus... i skillnad till collagen, ett fiberprotein)
(" Och ovalbumin det består väl av globulärt protein ... " "Och du består väl av människa...")
Slarva inte! Du kan det här!
Ett enskilt proteins struktur är ett komplext samspel mellan krafter som gynnar bildandet av en stabil struktur, och krafter som motverkar detta. Proteinet är generellt anpassat för att i sin naturliga miljö kunna veckas korrekt och uppnå en stabil struktur. Ändras miljön, som t.ex. vid kokning/syra/bas, påverkas dessa krafter och till slut övervinner de motverkande/destabiliserande krafterna och proteinet börjar veckas upp och kan till och med denaturera.
Finns det flera proteiner tillsammans, som i t.ex. äggvita, kommer de enskilda proteinerna påverkas och samtidigt kan de påverka varandra. Så trots att det inte går att beskriva hur en enskild typ av proteiner beter sig, går det att genrellt beskriva hur äggvitan beter sig.
Zockimon skrev:
Vad händer med högre temperatur upp till 100°C:
Svagaste binding är vätebindningar och joninteraktioner. De bryts vid den temperaturen, alfa-helix och beta-sheets och därmed proteinets struktur förstörs och det blir en "klump":
Äggen är kokt och proteiner denaturerade
Det finns i proteiner attraherande krafter på flera nivåer, i sekundärstrukturer (alfa-helixar/beta-strängar) mellan dessa sekundärstrukturer (dessa håller ihop proteinet). Inom en alfa-helix finns starka vätebindningar, och mellan olika alfa-helixar finns vätebindningar, van der Waals bindningar m.m.
Och trots att dessa bindningar var och en för sig kan vara mycket svaga (t.ex. van det Waals) så bidrar många olika bindningar till att "binda ihop" proteinets struktur. Summan av alla (svaga och starkare) bindningar ger en stark "ihopbindande" kraft, som ger upphov till proteinets struktur.
Så strikt sett är vätebindningen bland de starkare i ett protein, men för att få ett grepp om hur proteiner beter sig blir det enklare att betrakta proteinets struktur som en summan av alla olika stabiliserande bindningar. När ett protein denatureras genom t.ex. kokning, och sedan temperaturen sänks, kan alla delar av proteinet på nytt bilda bindningar till varandra. I cellen sker bildandet av dessa bindningar ordnat och med hjälp, vilket inte sker i den svalnande äggvitan. I stället sker bindningsbildningen kaotiskt, och de enskilda proteinmolekylerna "klumpar ihop".
Zockimon skrev:
Vad händer med basen?
sidokedjors amino-grupper blir neutrala och fler carboxygrupper blir laddade.
De bidrar dock inte till de viktiga strukturbildande elementer alfa-helix och beta-sheet och verkar inte spelar så stor roll i äggvitas proteiner.
Ja laddningen förändras på basiska grupper, som går från en positiv laddning till en neutral ju mer pH stiger. (Karboxylsyragrupperna bör redan vid neutralt pH vara helt protolyserade, d.v.s. i formen -COO-).
Men påståendet att aminogrupperna inte är viktiga för proteinets struktur stämmer inte. Aminogrupperna bidrar absolut t.ex. genom att bilda alfahelixar och betasträngar/flak, t.ex. som del i vätebindningar mellan aminogrupper och karbonylgrupper inom helixar/betastrukturer, men även mellan dessa helixar/betastrukturer. Saltbindningar m.m.
Arbetsmyran skrev:Jag har gjort en labb där vi undersöker olika faktorer som denaturerar proteiner. Men uppvärmningen denaturera mest medan basen gjorde det minst men varför? Jag tror att alla bindningar bryts i den som värms medan de endast är jon bindningen i prov röret med basen.
Du såg inte någon större skillnad efter tillsats av bas. Vad kan det betyda?
Vilket pH har äggvitan? pH ändras i ägget ju äldre det blir. Och om du inte tillsatte massvis med stark bas, kan det vara så att proteinerna i ägget (som tolererar en pH ökning över tid) kan tåla tillsats av lite bas.
Vet du vilket pH ni hade i slutet, efter tillsats av bas? Vilken bas var det förresten?


