Bestämma antalet atomer i enhetscell
Hej! Finns det något knep hur man vet hur man bestämmer sånthär i enhetsceller?
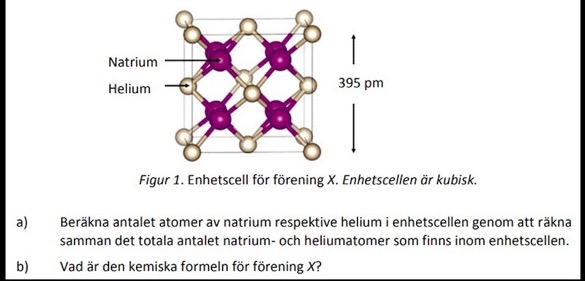
eller t.ex

Ja det finns det. I bägge fallen råder fcc-struktur, även kallat NaCl-struktur. Om man tittar på det tätpackade ämnet (helium i figuren) så finns 1/8 atom i alla 8 hörn, och 1/2 atom på alla 6 sidor. Totalt finns då 8*1/8+6*1/2=4 heliumatomer i enhetscellen. Det finns en natriumatom i varje tetraediskt hål, dvs totalt 8 natriumatomer.
Toppen. Är det bara natrium som skapar den strukturen? Finns det andra också, med specifika regler? Eller brukar endast denna tas upp på gymnasienivå? Vi har aldrig pratat om det.
Borde det då bli 4 kloridjoner i uppgift 2? svar iii?. Här ges ju ingen bild, ska man då lära sig att Na bildar den kristallstrukturen som du beskriver?
Tack!
Det var så länge sen jag gick gymnasiet (under en annan läroplan), så jag har inte koll på vad man lär sig där. När jag gick gymnasiet gick vi inte igenom enhetsceller eller så mycket om fasta tillståndets kemi i allmänhet.
Det är väldigt många föreningar som innehar fcc-struktur, bland annat natriumklorid, därför kallas strukturen ibland NaCl-struktur. Ett annat namn är kubisk tätpackning.
I salter styrs kristallstrukturen i hög grad av förhållandet mellan jonernas radier (i molekylföreningar har bindningsvinklarna också betydelse). Det finns tumregler för vilka radieförhållanden som brukar ge vilken struktur. I fallet NaCl är natriumjonen relativt liten så den får plats i de oktaedriska hålen i den tätpackade strukturen av kloridjoner. I andra salter, exempelvis cesiumklorid, är den positiva cesiumjonen mycket större än natriumjonen och då ryms inte jonerna i de oktaedriska hålen mellan kloridjonerna. Saltet får då en annan, s.k. rymdcentrerad struktur (bcc, även kallad CsCl-struktur). Där består enhetscellen av hörn med kloridjoner och en cesiumjon i det kubiska hålet.
Det finns många, många fler sorters kristallstrukturer som hexagonal, trigonal, ortorombisk etc.
Borde det då bli 4 kloridjoner i uppgift 2? svar iii?. Här ges ju ingen bild, ska man då lära sig att Na bildar den kristallstrukturen som du beskriver?
Nja, det är kloridjonerna som är kubiskt tätpackade med natriumjoner i de oktaedriska hålen. Det är inte riktigt samma som i första uppgiften, där natriumatomerna ligger i de tetraediska hålen. I ett oktaedriskt hål omges (koordinerar) atomerna i hålen sex tätpackade atomer. Man säger att koordinationstalet är 6.



