Beräkning av koncentrationer vid jämvikt
Hej! Jag fattar inte varför man skriver -0,5x vid förändringen oxh inte bara x om substansmänsförhpllander är 1:1:2?

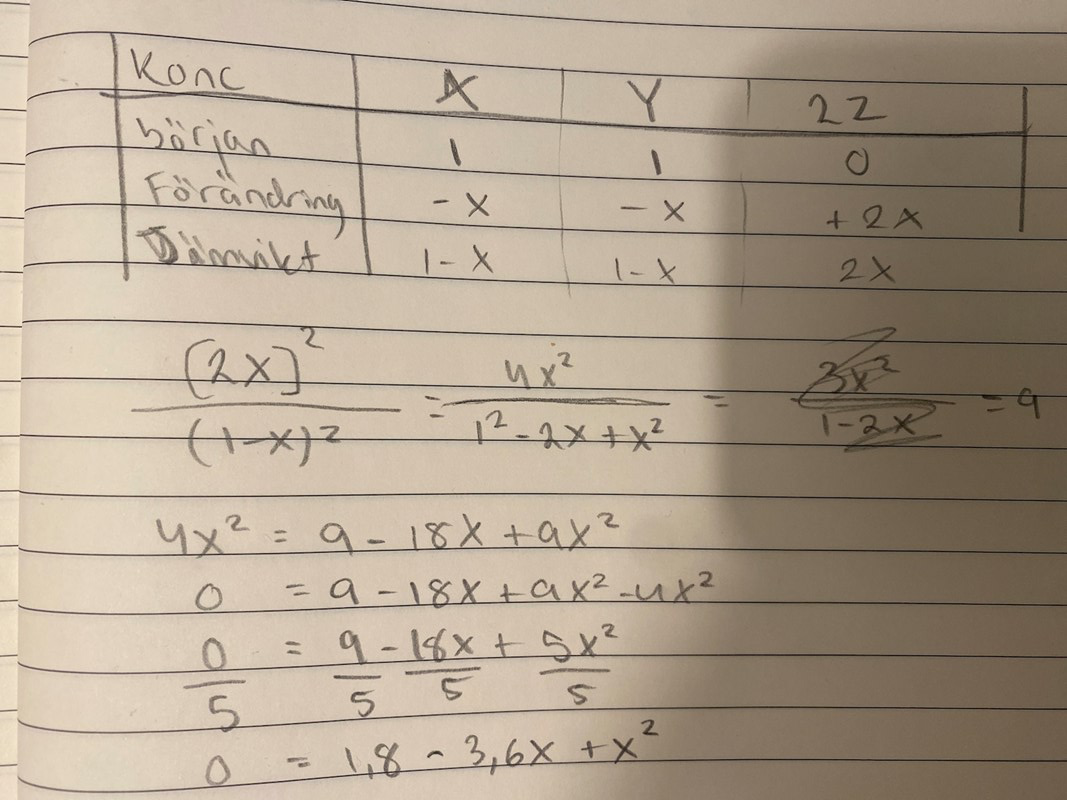
Jag tänker att det blir samma sak!
-0,5X : -0,5X : X
är ju samma som
X : X : 2X
dvs ett förhållande på 1:1:2 och därför är båda sätten att skriva på korrekt, så länge man är medveten om hur man definierat x.
Joo jag tänkte det men det går liksom inte o räkna med båda sätten. När jag löser följande uppgift såhär 
 går det inte att få ut ett värde på K
går det inte att få ut ett värde på K
Aa nu förstår jag!
När du har fått fram koncentrationen NO vid jämvikt så är det liksom lika med förändringen. Om du skriver ned hur det skulle bli innan du låter jämvikt ställa in sig skulle det ju se ut såhär:
| N2 | O2 | 2NO | |
| Början | 0,780 | 0,210 | - |
| Förändring | -x | -x | +2x |
| Jämvikt | 0,780-x | 0,210-x | 2x |
Nu kan vi utnyttja att vi faktiskt fått informationen om hur mycket NO som bildats.. Vi har fått en koncentration på 0.074 M (för NO). Detta är alltså jämviktskoncentrationen för NO och kan stoppas in i vår tabell istället för 2x. Detta eftersom att 2x beskriver jämviktskoncentrationen för NO precis som o.074 M gör. Detta ger oss att 2x=0.074. Men skulle vi istället för att sätta dessa lika med varandra, addera dem och försöka hitta ett värde på Ka så blir det, precis som du säger ganska så omöjligt.
Så; nu vet du att 2x=0.074. Du kan då ta reda på x, sätta in det i de andra uttrycken för jämviktskoncentrationerna och hitta ett värde på Ka.
Låter det rimligt?
åhhh jag förstår nu. Tusen tack!!
Ehm okej så jag trodde jag hade fattat. Men här blir det ändå fel på min orginalfråga

bump



