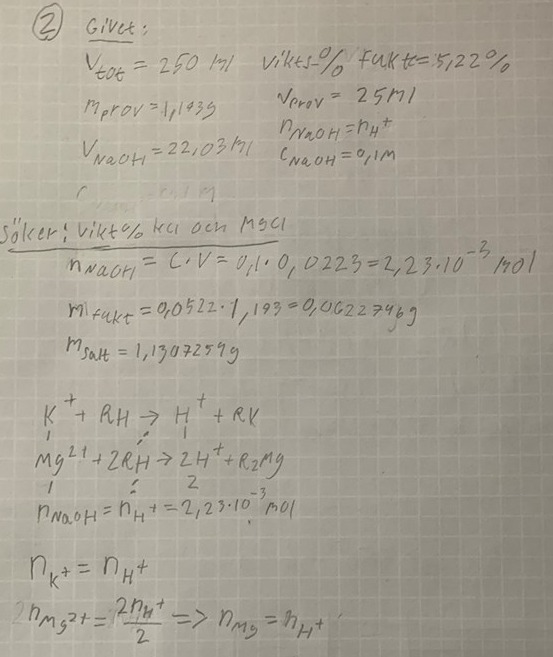Beräkna vikts-%
Hej, har fastnat med denna stökiometriuppgift. Här är frågan:
Ett fast prov innehåller okända mängder kalium- och magnesiumklorid samt fukt. 1,193g av provet löses i vatten och lösningen späds till 250 ml. 25 ml av provet tillåts passera en H+- mättad katjonbytare och eluatet förbrukar 22,03ml av en 0,1 M NaOH lösning. Fukthalten i provet bestämdes till 5,22% vikts-%. Beräkna vikts-% av kalium- och magnesiumklorid i provet.
Jag har lyckats räkna ut mängden fukt i provet men har ingen aning om hur jag ska ta mig vidare. Så här långt har jag kommit:
Välkommen till Pluggakuten!
Hur många gram blandat torrt salt fanns det i 1,193 g fuktigt salt?
Hur många g torrt salt fanns det i provet som tillsattes till katjonbytaren? Hur många mol positiv laddning fanns det i provet?
Du behöver lösa ett ekvationssystem för att lösa uppgiften.
Antalet gram salt är väll (totala massan - massan av fukt ) vilket blir ungefär 1,131g?
och är inte antalet mol positiv laddning samma som substansmängden för NaOH?
Fausto skrev:Antalet gram salt är väll (totala massan - massan av fukt ) vilket blir ungefär 1,131g?
jovisst
och är inte antalet mol positiv laddning samma som substansmängden för NaOH?
jovisst
Kan du ställa upp det ekvationssystem som behövs för att lösa uppgiften? När du lägger din tråd på universitetskemi så förväntas du behärska både Ke1 och Ma2, som är vad som behövs för att lösa den här uppgiften.
Om du behöver mer hjälp, så visa hur långt du har kommit och fråga igen.
Är jag på rätt väg här? Då borde Kaliumjonerna och magnesiumjonerna ha samma substansmängd

Fausto skrev:Är jag på rätt väg här? Då borde Kaliumjonerna och magnesiumjonerna ha samma substansmängd
De två sista raderna är fel. 1 mol kaliumjoner ger 1 mol oxoniumjoner, och 1 mol magnesiumjoner ger 2 mol oxoniumjoner, så substansmängden oxoniumjoner är lika med substansmängden kaliumjoner plus två gånger substansmängden magnesiumjoner.
Sätt t ex k = antal mol kaliumjoner och m = antal mol magnesiumjoner. Slå upp molmassorna för de båda salterna, och skriv en ekvation som säger att massan för de båda torra salterna är 1,13massadecimaler.
Kommer du vidare?
Ok nu har jag ställt upp ett samband, men det jag inte förstår är hur jag ska få fram substansmängden av jonerna. Jag vet ju bara substansmängden för H+.

Det andra sambandet har du fått beskrivet här:
1 mol kaliumjoner ger 1 mol oxoniumjoner, och 1 mol magnesiumjoner ger 2 mol oxoniumjoner, så substansmängden oxoniumjoner är lika med substansmängden kaliumjoner plus två gånger substansmängden magnesiumjoner.
Substansmängden oxoniumjoner är ju lika med substansmängden NaOH. Tänk på att det inte är hela lösningen som har hällts i katjonbytaren!
ifall jag förstått rätt så blir sambandet:
2,23*10^-3 = nk + 2nmg
hur ska jag få substansmängden för nk eller nmg när jag bara har värdet för nH+?
Fausto skrev:ifall jag förstått rätt så blir sambandet:
2,23*10^-3 = nk + 2nmg
Hur fick du det sambandet? Du behöver förklara vad det är du gör, inte bara slänga fram en massa siffror.
EIT: Aha, siffrorna är substansmängden hydroxidjoner - men tänk på att det bara är 1/10 av provet som har gått genom jonbytaren!
hur ska jag få substansmängden för nk eller nmg när jag bara har värdet för nH+?
Du behöver den andra ekvationen också. Som jag skrev tidigare:
Sätt t ex k = antal mol kaliumjoner och m = antal mol magnesiumjoner. Slå upp molmassorna för de båda salterna, och skriv en ekvation som säger att massan för de båda torra salterna är 1,13massadecimaler.
Kommer du vidare?
Så nu tror jag att jag har förstått hur man skulle göra, visst ser resultatet rimligt ut?
Det ser rimligt ut, men jag har inte kontrollräknat.
Ok, tack så mycket för hjälpen annars. Sorry att jag var lite trög i början
Det behöver du inte be om ursäkt för.