avogrados, mol m.m
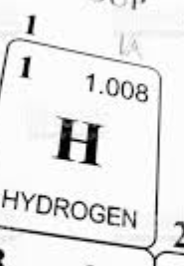
1,008 står för atomassan i Unit? om vi konverterar det till kg så blir det multiplicerat med 1,66 * 10-27 kg.
Alltså väger en atom av ämnet sådär många kg?
Men om vi har en mol av ämnet så är det alltså 6,022 * 1023 partiklar, och därför tar vi avogrados konstant * unit (från periodiska systemet) * 1,66 * 10-27 så får vi hur mycket en mol väger av ämnet?
vet inte om jag resonerar korrekt nu..
Ja precis, och då får du fram att en mol väger 1,008 gram.
Teraeagle skrev:Ja precis, och då får du fram att en mol väger 1,008 gram.
när räknar man med U och när räknar man med gram?
jag själv antar...
att man räknar med U när man har "antal mol" och lite mer generellt,
medan man räknar med g (multiplicerar in 1,66 * 10-24 eller 27 ) om det handlar om enstaka/några atomer?
Ja, typ så. Inom kemi räknar man nästan aldrig med u eller kg när det handlar om atomer, men inom fysik är det relativt vanligt. Det jag direkt tänker på är inom kärnfysik när man ska räkna ut hur mycket energi som frigörs vid en kärnreaktion.
Teraeagle skrev:Ja, typ så. Inom kemi räknar man nästan aldrig med u eller kg när det handlar om atomer, men inom fysik är det relativt vanligt. Det jag direkt tänker på är inom kärnfysik när man ska räkna ut hur mycket energi som frigörs vid en kärnreaktion.
så det är mest gram man räknar med alltså?
men vad innebär egentligen molmassa? alltså jag vet att det är g/mol, men det säger mig inte så mycket, och om man räknar med unit så går det väl inte att få fram molmassa, utan man måste konvertera till g först (för att kunna få ut det till g/mol?)
eller går det ändå?
Kemister räknar nästan aldrig i u.
Du krånglar till det en hel del. 1 u är ekvivalent med 1 g/mol, vilket du visade med din beräkning. En atom som väger 100 u har molmassan 100 g/mol, dvs en mol atomer väger 100 gram.
ja, jag känner också att jag krånglade till det igår en hel del igår klockan halv två på natten..
men substansmängd = antal molekyler = enhet: mol = avogrados konstant.
massa = förstått
molmassa = g/mol, det samma som unit även? som man finner i periodiska systemet
jag tror mitt största problem nu är molmassa och att jag inte förstår när det är man multiplicerar in --> * 1,66 * 10-27 eller 24
Du behöver aldrig multiplicera med massan för 1 u för att räkna med molmassa. Molmassa är den massa som 1 mol av ett ämne har. Molmassa mäts i enheten g/mol.
Om man av någon anledning vill räkna ut massan för 1 molekyl av ett ämne, så är molekylmassan samma siffror som molmassan, fast i enheten u. Om man vill kan man göra om u till kg (eller g), men det vill man oftastt inte. Sådana uppgifter förekommer nästan bara i kemiböcker.
Smaragdalena skrev:Du behöver aldrig multiplicera med massan för 1 u för att räkna med molmassa. Molmassa är den massa som 1 mol av ett ämne har. Molmassa mäts i enheten g/mol.
Om man av någon anledning vill räkna ut massan för 1 molekyl av ett ämne, så är molekylmassan samma siffror som molmassan, fast i enheten u. Om man vill kan man göra om u till kg (eller g), men det vill man oftastt inte. Sådana uppgifter förekommer nästan bara i kemiböcker.
1. molmassa kan fås genom M=m/n OCH M=m*NA?
men jag förstår inte hur M=m*NA gör att vi får ut molmassan? är det massa * avogrados? men hur är det så?
2. och det som skiljer 1 u och 1 g det är väl att
1 u = 1,66 * 1024 g?
och u beräknas främst med enstaka atomer? alltså en, två järnatomer exempelvis.
vet inte om jag rör ihop det men känns som de sakerna jag nämnt ovan är väldigt oklara för mig nu..
naturnatur1 skrev:Smaragdalena skrev:Du behöver aldrig multiplicera med massan för 1 u för att räkna med molmassa. Molmassa är den massa som 1 mol av ett ämne har. Molmassa mäts i enheten g/mol.
Om man av någon anledning vill räkna ut massan för 1 molekyl av ett ämne, så är molekylmassan samma siffror som molmassan, fast i enheten u. Om man vill kan man göra om u till kg (eller g), men det vill man oftastt inte. Sådana uppgifter förekommer nästan bara i kemiböcker.
1. molmassa kan fås genom M=m/n
Ja, eller genom att addera molmassorna för alla atomer som ingår i en molekyl.
OCH M=m*NA?
Här vet jag inte vad du menar. Vilken enhet skulle du få för molmassan här? I högerledet har massan m enheten gram, och Avogadros konstant är ett tal (antalet nånting i 1 mol). Det ger inte enheten g/mol.
men jag förstår inte hur M=m*NA gör att vi får ut molmassan? är det massa * avogrados? men hur är det så?
2. och det som skiljer 1 u och 1 g det är väl att
1 u = 1,66 * 1024 g?och u beräknas främst med enstaka atomer? alltså en, två järnatomer exempelvis.
vet inte om jag rör ihop det men känns som de sakerna jag nämnt ovan är väldigt oklara för mig nu..
I kemi räknar du nästan aldrig med enstaka atomer. Överlåt "u" till fysikerna, de behöver den enheten! Kemister behöver den inte (bara lite förenklat...)
Smaragdalena skrev:naturnatur1 skrev:Smaragdalena skrev:Du behöver aldrig multiplicera med massan för 1 u för att räkna med molmassa. Molmassa är den massa som 1 mol av ett ämne har. Molmassa mäts i enheten g/mol.
Om man av någon anledning vill räkna ut massan för 1 molekyl av ett ämne, så är molekylmassan samma siffror som molmassan, fast i enheten u. Om man vill kan man göra om u till kg (eller g), men det vill man oftastt inte. Sådana uppgifter förekommer nästan bara i kemiböcker.
1. molmassa kan fås genom M=m/n
Ja, eller genom att addera molmassorna för alla atomer som ingår i en molekyl.
OCH M=m*NA?
Här vet jag inte vad du menar. Vilken enhet skulle du få för molmassan här? I högerledet har massan m enheten gram, och Avogadros konstant är ett tal (antalet nånting i 1 mol). Det ger inte enheten g/mol.
jag syftade på det här (hittade det i ett kommentarsfält)
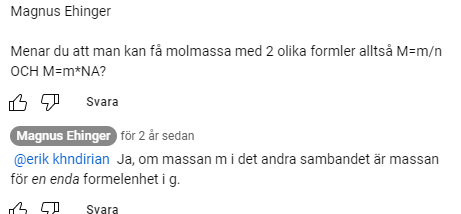
men nu är jag inte riktigt med på banan?
Om man formulerar så som han gör, att m är massan för EN ENDA MOLEKYL, så stämmer det. Då blir enheten g/molekyl * antal molekyler per mol, d v s g/mol. Långsökt, men sant.
Smaragdalena skrev:Om man formulerar så som han gör, att m är massan för EN ENDA MOLEKYL, så stämmer det.
Vad menar du?
Då blir enheten g/molekyl * antal molekyler per mol, d v s g/mol. Långsökt, men sant.
om man kollar på denna videon: https://www.youtube.com/watch?v=NWKUp1zXUMY&t=28s
så nämner han att det blir 6,022* 1023/mol ,
så länge man har någon massa i g, kan man alltså då multiplicera den med avorgados konstant och få ut molmassan då?
när han räknade ut sin molmassa tog han sin vikt * avorgados konstant
men när han sedan skulle räkna ut molmassan på en vätgasmolekyl så tog han massan för en ENDA molekyl (aha nu förstår jag vad du menar) men hur kunde han ovan ta hela sin massa, men nu använder han bara för EN molekyl?
Man kan i te räkna ut molmassan för en enda molekyl (men om man vet massan för en molekyl så kan man räkna ut molmassan).
Vad menar du med "hela sin madsa"?
Smaragdalena skrev:Man kan i te räkna ut molmassan för en enda molekyl (men om man vet massan för en molekyl så kan man räkna ut molmassan).
Vad menar du med "hela sin madsa"?
med "hela sin massa" mena jag att han tog sin vikt * avorgados konstant.
men om man ska använda denna formeln M=m*NA så måste man väl ha för en enda molekyl? hur kunde han ta hela sin vikt (i gram) och multiplicera den med avorgados konstant och få fram molmassan?
Är det nånting från filmen? Förklara vad,ni så fall.
Smaragdalena skrev:Är det nånting från filmen? Förklara vad,ni så fall.
såg nu att jag länkade fel video, det skulle vara denna: https://www.youtube.com/watch?v=Vqm5TcyY1Q0
han skulle räkna ut sin egna molmassa.
Det gjorde han genom att ta sin vikt * avorgados konstant.
Han omvandlade 93kg först till 93000g och multiplicerade sedan det med avorgados konstant och fick ut sin molmassa. (10 min in i videon)
Sedan skulle han räkna ut molmassan för en vätgasmolekyl
och det gjorde han genom att ta massan för en vätemolekyl (2,016 u?), och multplicerade in det med avorgados konstant
naturnatur1 skrev:Smaragdalena skrev:Är det nånting från filmen? Förklara vad,ni så fall.
såg nu att jag länkade fel video, det skulle vara denna: https://www.youtube.com/watch?v=Vqm5TcyY1Q0
han skulle räkna ut sin egna molmassa.
Det gjorde han genom att ta sin vikt * avorgados konstant.
Han omvandlade 93kg först till 93000g och multiplicerade sedan det med avorgados konstant och fick ut sin molmassa. (10 min in i videon)
Då räknade han tydligen ut hur många gram 1 mol stycken Magnus Ehinger skulle väga - rimligen mer äna hela Jorden!
Sedan skulle han räkna ut molmassan för en vätgasmolekyl
och det gjorde han genom att ta massan för en vätemolekyl (2,016 u?), och multplicerade in det med avorgados konstant
Nej, han räknade säkert ut molmassan för vätgas, eller molmassan för vätgasmolekyler (samma sak). Molmassan är ju för 1 mol molekyler, inte för en enda molekyl.



