Är detta ett korrekt tankesätt?
Jag vill bara veta att jag har förstått oxidationstalsmetoden ordentligt. Är min metod för att balansera följande redoxreaktion korrekt?
C7H8 + MnO4- → C6H5COO- + MnO2 (i basisk vattenlösning)
Vi börjar med att plocka fram förändringen i oxidationstal för kol och mangan:
C: → , e-/atom → -6e-/molekyl
Mn: VII → IV, +3 e-/atom → +3e-/jon
Detta kan man visualisera:
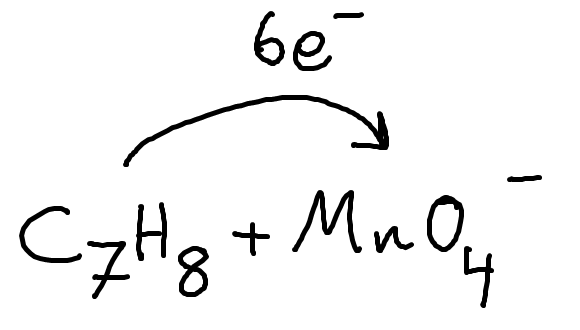
Men eftersom vi vet att permanganatet ska få 3e-/jon måste vi multiplicera med en koefficient 2:
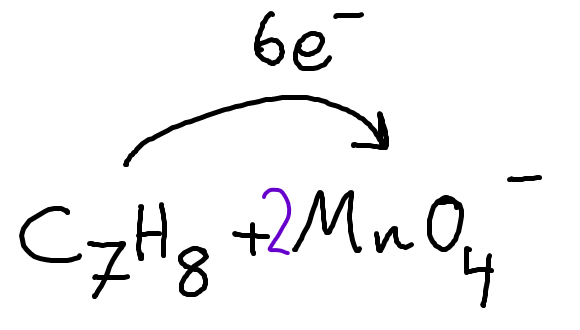
Då ser reaktionen ut så här:
C7H8 + 2MnO4- → C6H5COO- + 2MnO2
Nu gäller det att balansera laddningarna. I VL blir laddningssumman -2, och i HL blir den -1. Då lägger vi till en OH- i HL:
C7H8 + 2MnO4- → C6H5COO- + 2MnO2 + OH-
Nu är det enda som är kvar att balansera väte. I VL finns det åtta väte och i HL sex väte. Då ska det till två väte i HL, alltså en vatten:
C7H8 + 2MnO4- → C6H5COO- + 2MnO2 + OH- + H2O.
Helt riktigt, bra!
flikar in lite..
fattar inte riktigt det här 
hur kom du fram till -2/7 m.m?
och hur man drar slutsatsen när man ska tillsätta OH- och vattenmolekyler? typ som här:
har du/ någon lust att förklara? hade uppskattats.
hur kom du fram till -2/7 m.m?
I VL har kol oxidationstalet i snitt, eftersom väte har +I. Eftersom summan av oxidationstalen ska bli noll i den molekylen vet vi att kolets oxidationstal ges av ekvationen . I HL ser vi med samma resonemang att kol har ox-talet i snitt. Då har ox-talet alltså ökat med i snitt, alltså att molekylen ger bort 6e-/molekyl (det finns ju 7 kol i varje molekyl och om varje kol ger bort i snitt så blir det 6 totalt per molekyl).
och hur man drar slutsatsen när man ska tillsätta OH- och vattenmolekyler?
Eftersom vi måste balansera laddningarna och det står att reaktionen äger rum i en basisk vattenlösning, alltså en lösning där det finns OH-, får vi lägga till hydroxidjoner. Vattnet lägger vi till för att balansera vätet.
naytte skrev:hur kom du fram till -2/7 m.m?
I VL har kol oxidationstalet i snitt, eftersom väte har +I. Eftersom summan av oxidationstalen ska bli noll i den molekylen vet vi att kolets oxidationstal ges av ekvationen .
ja okej
I HL ser vi med samma resonemang att kol har ox-talet i snitt.
hur kom du fram till det? räknade du med totalt 7 kol? för det står ju C6H5COO-
syre har totalt -4, väte +5, alltså är det väl +1 som ska "fördelas" mellan kol, vilket då bör bli 1/7 väl? men hur får du det till -2/7
Då har ox-talet alltså ökat med i snitt,
-8/7 - -2/7 = 6/7 okej
alltså att molekylen ger bort 6e-/molekyl (det finns ju 7 kol i varje molekyl och om varje kol ger bort i snitt så blir det 6 totalt per molekyl).
aha här räknar du alltså för var och en kol?
och hur man drar slutsatsen när man ska tillsätta OH- och vattenmolekyler?
Eftersom vi måste balansera laddningarna och det står att reaktionen äger rum i en basisk vattenlösning, alltså en lösning där det finns OH-, får vi lägga till hydroxidjoner. Vattnet lägger vi till för att balansera vätet.
Det är sju kol i den jonen, inte en.
naytte skrev:Det är sju kol i den jonen, inte en.
ja jag menade "för var och en" kol.
alltså höger har -8/7 och sedan i vänster -2/7
sedan -8/7 - (-2/7) = -6/7
och när man räknar sedan för var och en, så tar man gånger 7, för att det fanns 7 kol. och då är det alltså 6 elektroner som förloras/förflyttas väl?
Ja, eftersom varje kolatom i genomsnitt avger e- måste en hel molekyl avge 6e-.
naytte skrev:Ja, eftersom varje kolatom i genomsnitt avger e- måste en hel molekyl avge 6e-.
tack snälla!
så oxidationstal kan alltså vara i bråkform? (inte samma med mol/när man balanserar?) typ att man inte kan lägga till 2,5 vattenmolekyl?
förresten med tanke på att kol står först som C6H5 och sedan som COO- ,
slår man alltså ihop kolen redan till en början (alltså till 7 kol)? de får alltså inte två olika oxidationstal? som i fallet med NH4NO3?
De har olika oxidationstal men man behöver inte bestämma alla dessa för att lösa uppgiften, det räcker att bestämma ett medeloxidationstal som naytte har gjort.



