Alkoholer med långa kolkedjor är mer svårlösliga i vatten än de med korta
Hej!
I min lärobok står det att etanol kan lösas i vatten, och bild på hur visas till höger i nedan bild. Men det står att alkoholer med långa kolkedjor, tex pentanol, har svårt att lösas i vatten på grund av att det är så stor del med van der Waalsbindningar istället för vätebindning. Men jag förstår inte varför. Till vänster i bilden nedan har jag målat hur jag tänker att en vattenmolekyl borde kunna binda till en pentanolmolekyl, men då borde ju flera vattenmolekyler kunna binda till en och samma pentanolmolekyl, vilket talar emot att alkoholer med långa kolkedjor är svårlösliga i vatten.
Tacksam om någon kunde förklara detta:)

naturaren1 skrev:Hej!
I min lärobok står det att etanol kan lösas i vatten, och bild på hur visas till höger i nedan bild.
Ja till vänster visas hur etanolen kan vätebinda till vattenmolekylen genom alkoholgruppen (hydroxigruppen).
Men det står att alkoholer med långa kolkedjor, tex pentanol, har svårt att lösas i vatten på grund av att det är så stor del med van der Waalsbindningar istället för vätebindning. Men jag förstår inte varför. Till vänster i bilden nedan har jag målat hur jag tänker att en vattenmolekyl borde kunna binda till en pentanolmolekyl, men då borde ju flera vattenmolekyler kunna binda till en och samma pentanolmolekyl, vilket talar emot att alkoholer med långa kolkedjor är svårlösliga i vatten.
Som du ritat det till höger går det inte att skapa en bindning. För en vätebindning sker mellan en hydroxigrupp i en molekyl, till en hydroxigrupp i en annan molekyl, som i bilden nedan.
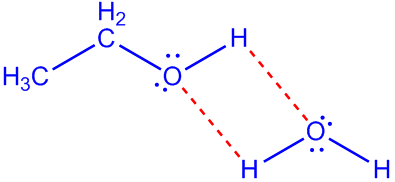
Alkylkedjan (CH3-CH2-CH2-CH2-CH2-) kan skapa van der Waalsbindningar, men kan inte delta i vätebindningar (som du ser saknas det hydroxigrupper) - så den delen vill inte blanda sig alls med vatten.

